Neu in der Kinderdermatologie
 Neu in der Kinderdermatologie
Neu in der Kinderdermatologie
Das Spektrum von Hautkrankheiten im Kindes- und Jugendalter ist breit. Es reicht von angeborenen genetischen Erkrankungen, Fehl- und Neubildungen hin zu infektiösen, allergischen und entzündlichen Krankheitsbildern.
Die Kinderdermatologie bringt dabei besondere Herausforderungen in der Diagnostik und Therapie mit sich. Im Wesentlichen gilt es bei der Beschreibung der Effloreszenzen, deren Verteilung (Mustererkennung, „Pattern Recognition“) und Befundinterpretation im alterstypischen Kontext weiterführende Untersuchungen gezielt einzusetzen, um so Belastungen für Kind und Eltern zu vermeiden.
Hinzu kommt, dass für zahlreiche Dermatosen des Kindesalters zugelassene Medikamente fehlen und daher die Therapie häufig als individueller Heilversuch (Off-Label-Use) erfolgen muss. Das galt lange Zeit sogar für das Management häufiger Krankheitsbilder, wie der schweren atopischen Dermatitis und Psoriasis. Inzwischen stehen jedoch für diese Altersgruppe zugelassene Systemtherapien zur Verfügung, die bei Ausschöpfen von Lokalmaßnahmen neue Perspektiven eröffnen. Drei Beispiele aus der Praxis sollen den Aspekt der Systemtherapie beleuchten.
Fall 1: „Austherapiert?“
Ein acht Monate alter Säugling wurde uns mit therapierefraktärer superinfizierter Dermatitis zugewiesen.
Mit Manifestation erster Ekzeme im zweiten Lebensmonat zeigte sich seither ein hochchronischer Verlauf – trotz Behandlung mit rückfettenden Cremes, topischen Antibiotika (Fusidinsäure) und Antimykotika (Nystatin, Clotrimazol), Glukokortikoiden (Betamethason, Hydrocortisonbuteprat, Methylprednisolonaceponat) und Calcineurininhibitoren (Pimecrolimus).
Im Zuge von Exazerbationen und Nachweis von Staphylokokkus aureus im Hautabstrich wurde das Kind mehrfach stationär antibiotisch (Cefuroxim, Cefaclor, Erythromycin, Clindamycin) behandelt, was jedoch nur kurzzeitig positiven Einfluss auf das Hautbild hatte. Eine Stabilisierung des Hautbildes ließ sich auch hierunter nicht erreichen. Aus Voruntersuchungen bekannt waren bei stark erhöhtem Gesamt-IgE (1.100 kU/l) multiple Typ-I-Sensibilisierungen (Hühnerei, Soja, Erdnuss, Weizenmehl, Kuhmilch).
Ergänzend zur Beikost, die im 6. Monat begann, erhielt der Junge eine aminosäurebasierte Formulamilch. Der Verzicht auf Hühnerei, Weizenmehl und Kuhmilch blieb zwar ohne Effekt auf das Hautbild, diese Nahrungsmittel wurden jedoch „sicherheitshalber“ weiter gemieden, ebenso Soja und Erdnuss.
Diagnostik
Klinisch zeigten sich bei dem Jungen (81 cm, 9,8 kg) exsudative, teils krustig belegte erythematöse Plaques (Abbildung 1) im Bereich von Wangen, Körperstamm und Extremitäten mit multiplen Kratzexkoriationen – SCORAD: 80.
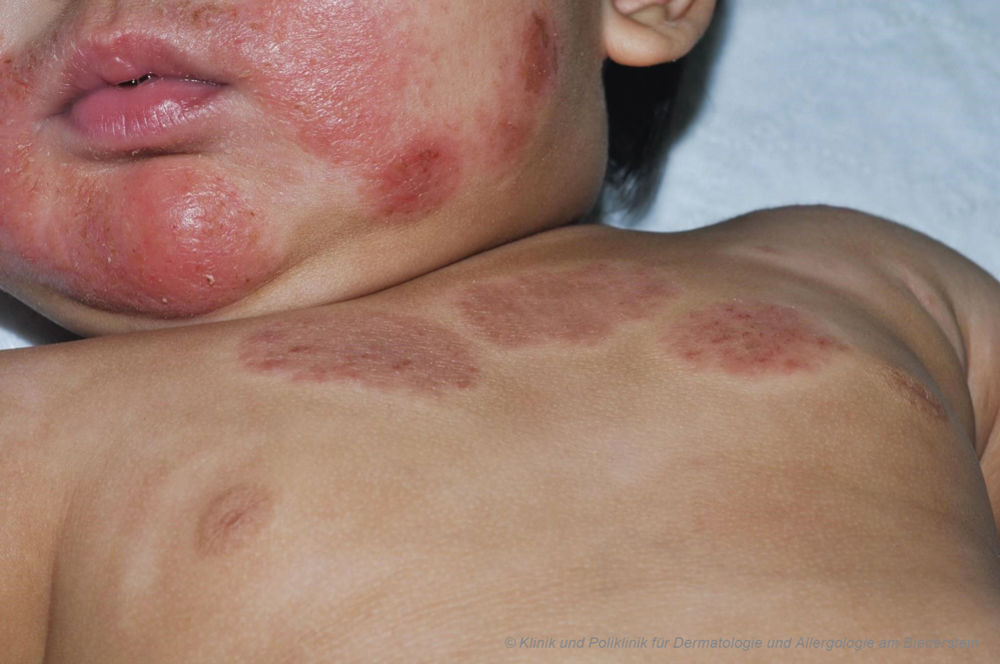
Abbildung 1: Nässend-krustige erythematöse Plaques im Bereich des unteren Gesichts und des angrenzenden Oberkörpers.
Mikrobiologischer Abstrich: Koagulase-negative Staphylokokken.
Labor: Differenzialblutbild mit Leukozytose (18,35/nl, Referenz < 18) und Eosinophilie (11 Prozent). IgA, IgM, IgG im Referenzbereich, IgE: 1.100 kU/l (Referenz < 15 IU/ml). Zellulärer Immunstatus, einschließlich Th-17-Analyse: unauffällig (Ausschluss zellulärer Immundefekt).
Diagnose
Schweres atopisches Ekzem, nummulärer Typ.
Therapie und Verlauf
Auch unter nochmals adaptierter Lokaltherapie (Hydrophile Prednicarbat 0,15 Prozent – Octenidin 0,1 Prozent-Creme, Pimecrolimus; Basistherapie mit Einbezug fett-feuchter Verbände, antiseptische Bäder) hielt der persistierende Verlauf an. Mit Einleitung von Dupilumab (200 mg, subkutan, alle vier Wochen) und fortgesetzter Basis- und antientzündlicher Lokaltherapie ließ sich eine rasche Besserung des Juckreizes feststellen – und sukzessive Besserung der Ekzeme. Innerhalb weniger Wochen nahm die Ekzemintensität (SCORAD: 15) so weit ab, dass ein proaktives Schema (2 x/Woche) bei der äußerlichen Behandlung zur Stabilisierung des Hautbildes ausreichte.
Diskussion
Die atopische Dermatitis ist die häufigste chronische Hauterkrankung im Kindesalter. Pathogenetisch wirken eine genetisch bedingte Hautbarrierestörung mit erhöhtem transepidermalen Wasserverlust, Immundysregulation (Dominanz von TH2-Zellen mit Schlüsselmediatoren: IL-4, IL-5 und IL-13) und Dysbiose des Hautmikrobioms zusammen. Zusätzlichen Einfluss haben Umweltfaktoren (unter anderem Allergene, Mikroorganismen, klimatische Einflüsse, Umweltschadstoffe).
Die nummuläre Variante bei unserem Patienten unterscheidet sich von der „klassischen“ Form (flächige, schuppende Erytheme) durch eine stärkere Infiltration und exsudativen Charakter, was als Infektion (zum Beispiel Dermatomykose) fehlgedeutet werden kann. Letzterem liegt in der Regel eine intensive Besiedelung mit Staphylococcus aureus vor, weshalb antiseptische Maßnahmen sinnvoll sind. Topische Antibiotika sind aufgrund einer möglichen Resistenzbildung kritisch, systemische Gaben sind nur bei klinischen Superinfektionen in Kombination mit antientzündlicher Lokaltherapie angezeigt. Die atopische Dermatitis ist eine klinische Diagnose. Weiterführende Abklärungen können bei Kleinkindern zur Differenzialdiagnostik sinnvoll sein: Zum Beispiel bei schwerem Verlauf und zusätzlichen Symptomen (zum Beispiel Gedeihstörung, Diarrhoe, Infektanfälligkeit) oder Befunden (z. B. Hypereosinophilie, stark erhöhtes Gesamt-IgE). Ca. 15 Prozent der betroffenen Kleinkinder weisen eine schwere atopische Dermatitis auf. Dabei hat der so genannte frühpersistierende Typ unseres Patienten ein hohes Risiko für die Entwicklung einer allergischen Komorbidität. Im Zentrum steht hier die frühkindliche Hautbarrierestörung, die eine Entwicklung von (Nahrungsmittel-)Sensibilisierungen begünstigen kann. Eine allergologische Diagnostik sollte stets anamnesegeleitet erfolgen. Nachgewiesene Sensibilisierungen bedürfen stets einer Überprüfung ihrer Relevanz, um so nicht-indizierte Diäten zu vermeiden (Risiko für Mangelversorgung, ggf. auch Anaphylaxien). Bezüglich der polyvalenten Typ-1-Sensibilisierungen im beschriebenen Fall sind im weiteren Verlauf Provokationstestungen geplant.
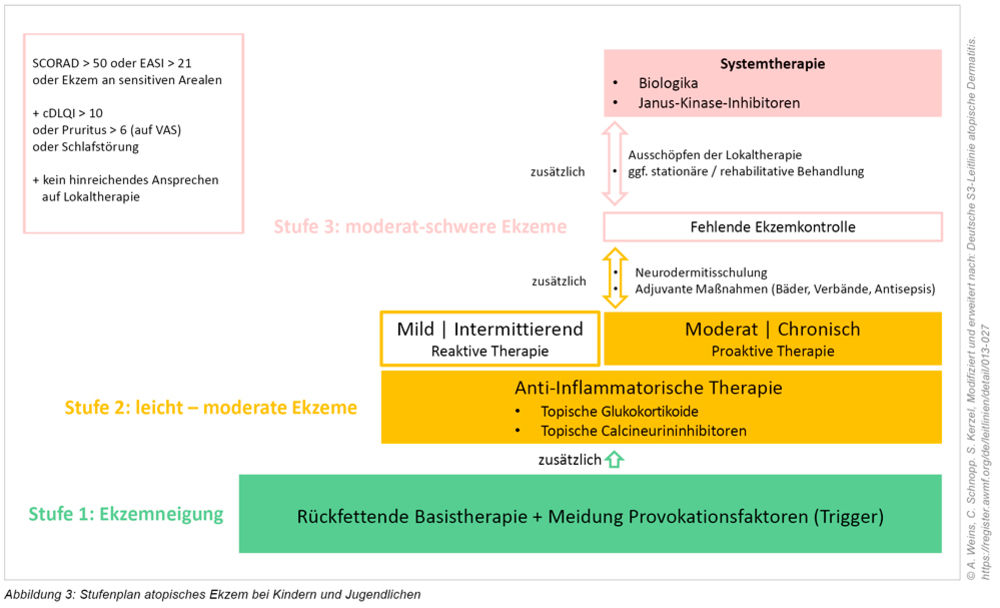
Bei unserem Patienten war nach Ausschöpfen ambulanter und stationärer Möglichkeiten (Abbildung 3) eine Systemtherapie indiziert. Bis vor kurzem konnte dies nur nach strenger Indikationsstellung mittels Einsatzes von Immunsuppressiva (Ciclosporin, zum Beispiel ab 16 Jahren zugelassen) stattfinden. Inzwischen sind nun auch für Säuglinge und Kleinkinder immunmodulatorische Wirkstoffe (Biologika, Janus-Kinase-Inhibitoren, siehe Abbildungen 2 und 3) zugelassen, die sehr viel gezielter in das Entzündungsgeschehen eingreifen. Vorteilhaft im Kindesalter ist die orale Gabe von Janus-Kinase-Inhibitoren (täglich), während Biologika subkutan (Intervall: mehrwöchig) verabreicht werden müssen.
Anders als bei Biologika sind vor Therapiebeginn mit Janus-Kinase-Inhibitoren Voruntersuchungen (unter anderem Ausschluss chronischer Infektionen, wie zum Beispiel Hepatitis, HIV, Tuberkulose) angezeigt, ebenso werden regelmäßige Laborkontrollen unter laufender Behandlung empfohlen.
Vor Therapiebeginn wird für beide Wirkstoffklassen die Durchführung aller altersgemäßen Impfungen gemäß den aktuellen Impfrichtlinien empfohlen.
Fall 2: „Damit müssen wir leben(?)“
Ein achtjähriges Mädchen wurde uns mit therapierefraktärer Psoriasis vulgaris zugewiesen. Lokaltherapien mit ureahaltigen Lotionen, topischen Glukokortikoiden (Prednicarbat, Methylprednisolonaceponat) und Calcineurininhibitoren (Pimecrolimus) blieben ohne zufriedenstellende Wirkung. Neben dem Befall direkt sichtbarer Hautareale belastete zusätzlich auch der begleitende Juckreiz der Hautveränderungen.
Laboruntersuchungen (Blutbild, C-reaktives Protein, Antistreptolysin-Titer) bezüglich eines möglichen Infektfokus waren unauffällig. Ebenso blieben Auslassversuche auf Weizen und Gluten bei wiederkehrenden Bauchschmerzen ohne Einfluss auf die Haut. Bei dem Vater des Mädchens war ebenfalls eine Psoriasis und eine Zöliakie bekannt.
Diagnostik
Klinisch zeigten sich bei der Patientin disseminierte erythematosquamöse Plaques (Abbildung 4) im Bereich von Gesicht, Körperstamm und den Streckseiten der Extremitäten – PASI > 10.
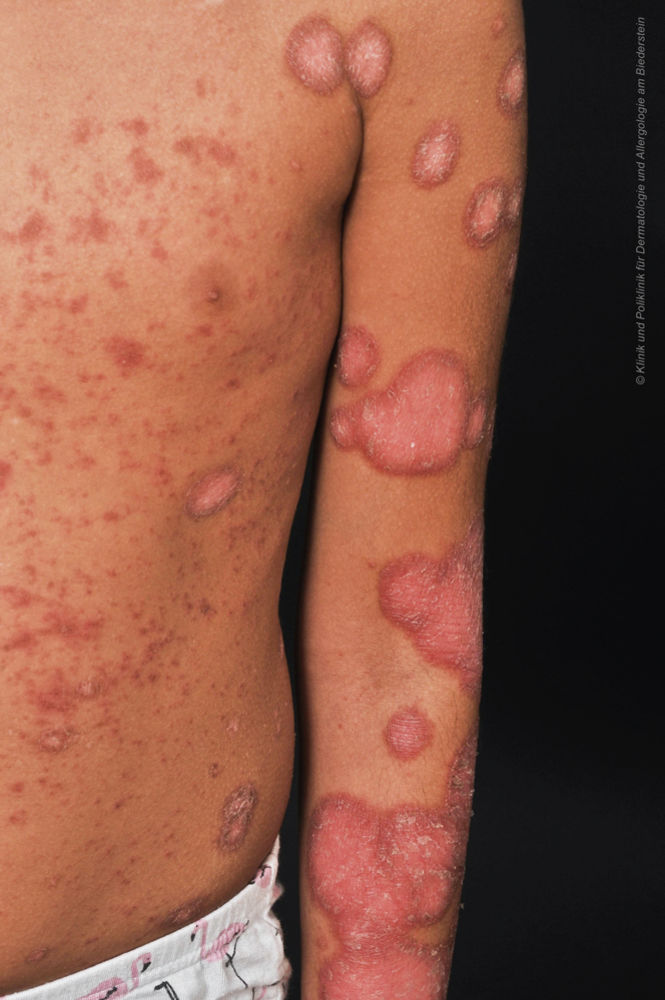
Abbildung 4: Erythematosquamöse Plaques am Körperstamm und Extremitäten.
Labor: Tb-ELISpot: negativ, HIV-Suchtest: negativ, Hepatitis-Serologie: ohne Hinweis für akute/chronische Infektion. Calprotectin im Stuhl: im Referenzbereich, IgA im Normbereich, kein Nachweis von Transglutaminase-/Endomysium-Antikörper.
Diagnose
Schwere Psoriasis vulgaris
Therapie und Verlauf
Auch unter einer nochmals eskalierten Lokaltherapie mit Mometasonfuroat und Calcipotriol-Salbe ließ sich keine zufriedenstellende Besserung erreichen, sodass nach Abschluss der Voruntersuchungen eine Systemtherapie mit Adalimumab eingeleitet wurde.
Hierunter kam es über sechs Monate zu einer sukzessiven Abnahme des Hautbefalls mit inzwischen stabil gebessertem Hautbild (PASI: 2) unter begleitender Lokaltherapie.
Diskussion
Die Psoriasis stellt die zweithäufigste chronisch-entzündliche Hauterkrankung des Kindes- und Jugendalters dar. Bei jedem dritten Psoriasis-Patienten treten die ersten Hautveränderungen bereits in der Kindheit auf. Charakteristisch sind infiltrierte Plaques mit anhaftender, weiß-gräulicher groblamellärer Schuppung.
Bei Manifestation im Säuglings- und Kleinkindalter kann das Bild deutlich hiervon abweichen, weshalb beispielsweise bei sehr hartnäckigen Formen einer „Windeldermatitis“ die Diagnose einer Psoriasis erst spät gestellt bzw. verkannt bleiben kann.
Exanthematische Formen (Psoriasis guttata) werden häufig im Kontext von Streptokokkeninfektionen (Tonsillitis, Pharyngitis, perianale Dermatitis) beobachtet.
Auch die Psoriasis ist eine klinische Diagnose, für die der Leitspruch „Die Schuppenflechte juckt nicht“ häufig miteinbezogen wird. Dennoch kann Juckreiz neben den Hautveränderungen selbst (zum Beispiel Schamgefühle, Stigmatisierung) bei Kindern und Jugendlichen maßgeblich zur Beeinträchtigung der Lebensqualität beitragen.
Pathogenetisch handelt es sich bei der Psoriasis um eine multifaktorielle Erkrankung, bei der genetische, immunologische und Umweltfaktoren zusammenwirken. Die Psoriasis wird mittlerweile als Systemerkrankung betrachtet, was letztlich auch mögliche assoziierte Erkrankungen (kardiovaskuläre, Stoffwechsel-, sowie chronisch entzündliche – unter anderem Darm, Augen, Gelenke – und psychiatrische Erkrankungen) im Kontext der chronischen Entzündung erklärt. Infolge des zu erwartenden chronischen Krankheitsverlaufs bei Manifestation im Kindesalter kommt dem frühzeitigen Erkennen und Management möglicher Begleiterkrankungen besondere Bedeutung zu.
Hier kann die pädiatrische Dermatologie die Funktion als „Gatekeeper“ haben, indem bei entsprechenden Hinweisen die Weichen für eine multiprofessionelle Versorgung gelegt werden. Bei unserer Patientin wurde im Vorfeld der Systemtherapie eine chronisch entzündliche Darmerkrankung ausgeschlossen, die beispielsweise durch IL-17-Blocker getriggert werden kann.
Über die letzten Jahre haben sich die Therapiemöglichkeiten der juvenilen Psoriasis mit hohem Schweregrad und unzureichendem Ansprechen auf die Lokaltherapie (Keratolytika, topische Glukokortikosteroide, Vitamin-D-Analoga ab 6 Jahren, Dithranol, Off-Label: topische Calcineurininhibitoren) deutlich erweitert (Abbildung 5). Nachdem in der Vergangenheit bislang nur konventionelle Immunsuppressiva (Methotrexat, Ciclosporin, Mycophenolat-Mofetil) bzw. Retinoide (pustulöse Psoriasis) im Rahmen eines Off-Label-Use zur Verfügung standen, sind mittlerweile mehrere Biologika mit zielgerichteter Wirkweise für Kinder und Jugendliche zugelassen. Systemische Glukokortikosteroide haben aufgrund eines zu erwartenden „Rebounds“ (Verschlechterung nach Absetzen, ggf. über den Ausgangszustand hinaus) keinen Stellenwert innerhalb der Behandlung. Biologika werden als subkutane Injektion in Intervallen von mehreren Wochen verabreicht, was im Rahmen der kinder- oder hautfachärztlichen Versorgung stattfinden kann.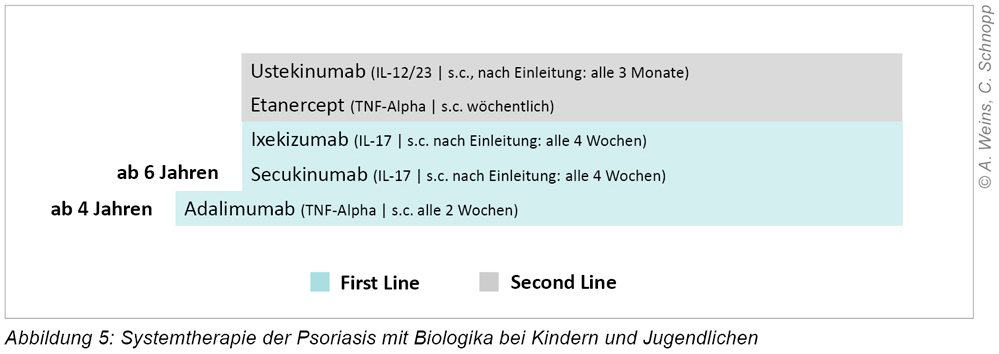
Die Indikationsstellung erfolgt in der Regel über spezialisierte Sprechstunden in Kliniken oder Praxen. Die Therapieentscheidung hängt dabei primär vom Zulassungsalter der einzelnen Wirkstoffe, aber auch möglichen assoziierten Erkrankungen ab. Vor Einleitung bedarf es umfangreichen Voruntersuchungen (unter anderem Ausschluss chronischer Infektionen wie Hepatitis, HIV und Tuberkulose), aber auch unter Therapie sind regelmäßige Laborkontrollen angezeigt.
Fall 3: „Narbige Verhärtung der Haut ohne Trauma“
Ein neunjähriges Mädchen wurde uns mit zunehmender „narbiger Verhärtung“ der Haut (Abbildung 6) im Bereich der linken Schulter und des angrenzenden Oberarms vorgestellt.
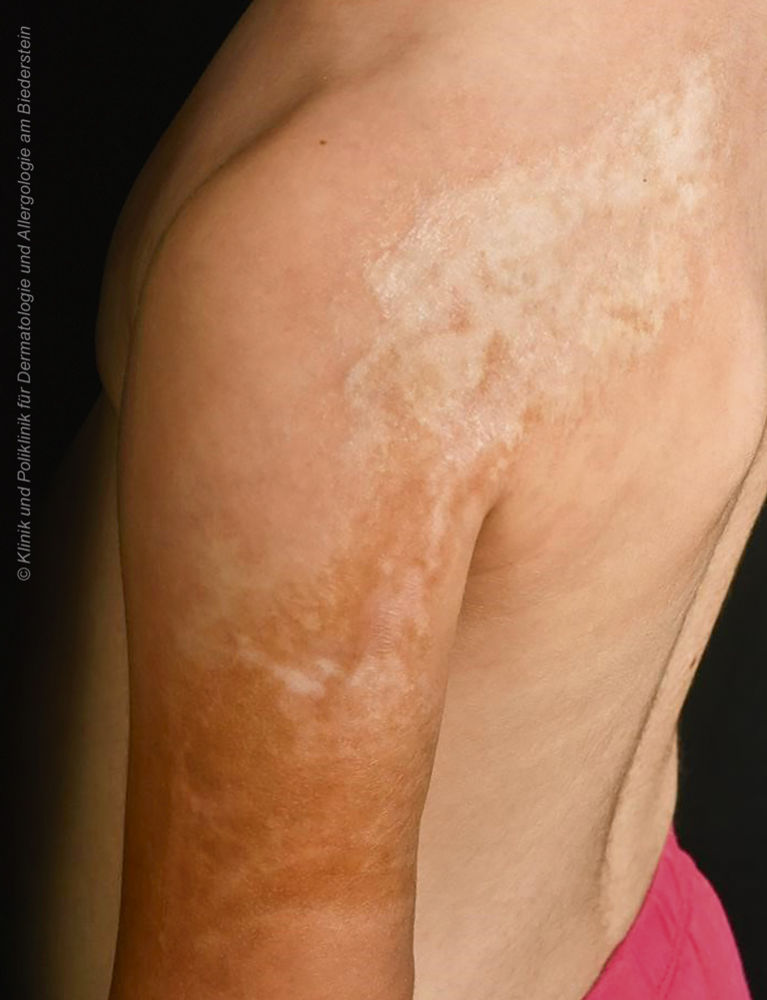
Abbildung 6: Lineare weißlich-sklerotische Induration an der linken Schulter und Oberarm
Diagnostik
Labor: Differenzialblutbild, Leber- und Nierenfunktionsparameter, einschließlich Entzündungsparameter (CRP) unauffällig. ANA-negativ. Tb-ELISpot: negativ, HIV-Suchtest: negativ, Hepatitis-Serologie: ohne Hinweis für akute/chronische Infektion.
Diagnose
Lineare zirkumskripte Sklerodermie
Therapie und Verlauf
Nach Abschluss der erforderlichen Voruntersuchungen begannen wir eine Therapie mit Methotrexat (Dosierung: 15 mg, s. c. einmal wöchentlich), die von einer Supplementierung von Folsäure (5 mg, p. o., am Folgetag der Injektion) begleitet war. Unter der zusätzlichen Lokaltherapie mit Mometasonfuroat und Calcipotriol-Salbe kam es innerhalb eines Jahres zu einer sukzessiven Abnahme der Sklerose mit Ausbildung einer postinflammatorischen Hyperpigmentierung.
Diskussion
Bei der zirkumskripten Sklerodermie handelt es sich um eine chronisch-entzündliche fibrosierende Bindegewebserkrankung. Anhand Manifestation und Verteilung lassen sich verschiedene Formen (limitiert, linear, generalisiert) unterscheiden, wobei die lineare Form die häufigste Variante bei Kindern und Jugendlichen darstellt. Die lineare zirkumskripte Sklerodermie stellt eine klinische Diagnose dar, die anhand der charakteristischen Klinik (sklerotische Induration, streifiges Verteilungsmuster) gestellt werden kann. Eine bioptische Sicherung ist meist nicht erforderlich. In ihrer Frühphase kann die sklerotische Induration jedoch noch fehlen und stattdessen nur Erytheme mit nur minimaler Texturveränderung zu sehen sein.
Die lineare Sklerodermie zeigt eine meist einseitige, streifenförmige Manifestation entlang einer Extremität, dem Kapillitium (Typ „en coup de sabre“), oder seltener, dem Stamm.
Deutlich häufiger als bei dem oberflächlichen Plaque-Typ kann es bei der linearen zirkumskripten Sklerodermie zu tiefen Defekten, Funktionseinschränkungen und Entstellung kommen. Bei der Sklerodermie „en coup de sabre“ kann es zudem zu begleitenden neurologischen, okulären oder ossären Veränderungen kommen. Eine weiterführende Abklärung (unter anderem MRT) ist hier, wie auch bei entsprechenden Hinweisen, indiziert. Das Versorgungskonzept sollte idealerweise interdisziplinär, zum Beispiel mit Einbezug von Kinderorthopädie und -rheumatologie, ausgelegt sein.
Um ein Voranschreiten der Sklerosierung sowie extrakutane Komplikationen zu vermeiden, ist eine frühzeitige Diagnosestellung und Behandlung wichtig.
Off-Label, aber Therapie der ersten Wahl bei der linearen zirkumskripten Sklerodermie ist Methotrexat (MTX), bei rascher Progredienz initial in Kombination mit oralen Glukokortikosteroiden. Die MTX-Dosis wird anhand der Körperoberfläche (15 mg/m2, s. c. oder p. o. einmal wöchentlich) berechnet. Der Behandlungszeitraum beträgt in der Regel zwölf Monate, Rezidive sind nach Absetzen dennoch möglich. Obligat ist neben einem Monitoring auf mögliche unerwünschte Wirkungen zudem die Ergänzung von Folsäure (1 mg täglich oder einmalig 5 mg am Folgetag zur MTX-Gabe) zur Reduktion einer möglichen gastrointestinalen Toxizität.
Das Literaturverzeichnis kann im Internet unter www.bayerisches-aerzteblatt.de (Aktuelles Heft) abgerufen werden.
Interessenkonflikt
A. Weins: Honorare für Vorträge für Sanofi-Regeneron, Novartis, Lilly und Abbvie.
C. Schnopp: Honorare für Vorträge und Beratertätigkeit für Sanofi-Regeneron, Novartis, Lilly, Abbvie.
Das Wichtigste in Kürze
» Die atopische Dermatitis, Psoriasis und lineare zirkumskripte Sklerodermie sind Beispiele für Dermatosen des Kindesalters, die klinisch gestellt werden.
» Eine weiterführende Abklärung bei atopischer Dermatitis sollte anamnesegeleitet, zum Beispiel bei Hinweisen für einen allergischen Provokationsfaktor oder zum Zwecke der Differenzialdiagnostik bei Begleitsymptomen (zum Beispiel pathologische Infektanfälligkeit, Gedeihstörung) bzw. Befunden (zum Beispiel Hypereosinophilie, Hypogammaglobulinämie) erfolgen.
»Das Management der atopischen Dermatitis und Psoriasis folgt jeweils einem Stufenplan.
»Bei hohem Schweregrad und Ausschöpfen von Lokaltherapien stehen für atopische Dermatitis und Psoriasis mittlerweile zielgerichtete immunmodulierende Medikamente zur Systemtherapie bei Kindern und Jugendlichen zur Verfügung.
»Die atopische Dermatitis und Psoriasis können mit Begleiterkrankungen einhergehen, weshalb die Kinderdermatologie Gatekeeper für eine multiprofessionelle Versorgung sein kann.
Autoren

Privatdozentin Dr. Christina Schnopp 3, 4
1
Klinik für Kinder- und Jugendmedizin, Universitätsklinikum Augsburg, Stenglingstraße 2, 86156 Augsburg
2
KIDZ SKIN
Praxis für Kinder- und Jugenddermatologie, Münsterplatz 20, 89073 Ulm
3
Klinik und Poliklinik für Dermatologie und Allergologie am Biederstein, Klinikum rechts der Isar, Technische Universität München,
Biedersteiner Straße 29, 80802 München
4
Hautarztpraxis Burgstraße, Burgstraße 7, 80331 München
Teilen:
Das könnte Sie auch interessieren: