Neu in der Nierentransplantation
 Nierentransplantation
Nierentransplantation
Ein terminales Nierenversagen kann mittels Dialyse oder Nierentransplantation behandelt werden. Eine Transplantation ist für geeignete Patientinnen und Patienten die bessere Nierenersatztherapie, weil sie den Betroffenen eine längere Lebenszeit und eine bessere Lebensqualität ermöglicht.
Allerdings stehen für die rund 100.000 Dialysepatienten in Deutschland jährlich nur 1.500 postmortale Spenderorgane zur Verfügung, des Weiteren erfolgen rund 600 Lebendnierentransplantationen von nahen Angehörigen. Folglich werden in Deutschland auch nur etwa 20.000 transplantierte Patienten betreut. Im internationalen Vergleich sind diese Zahlen beschämend niedrig, unsere europäischen Nachbarländer transplantieren zumeist doppelt bis dreimal so häufig.
Neben gesetzlichen Verbesserungen der Rahmenbedingungen für Organspende und Transplantation in Deutschland ist es deshalb von höchster Wichtigkeit, jede einzelne Transplantation bestmöglich vorzubereiten und nachzusorgen. In diesem Artikel werden bedeutsame Neuerungen der Steuerung einer immunsuppressiven Therapie, der Behandlung von Abstoßungsreaktionen und der künftigen Optionen für Lebendnierentransplantationen vorgestellt.
Fall 1: Torque-Teno-Virus gesteuerte Immunsuppression
Im Alter von 38 Jahren wird bei einem männlichen Patienten die Diagnose einer polyzystischen Nierenerkrankung mit bereits fortgeschrittener Niereninsuffizienz gestellt. Die Einleitung einer Hämodialysebehandlung erfolgte im Alter von 43 Jahren. Nach sieben Jahren erfolglosen Wartens auf eine postmortale Transplantation nahm der Patient das Angebot seiner Ehefrau an und ließ eine Lebendnierentransplantation vornehmen. Hierfür zeigte sich im Rahmen der Vorbereitungen eine für Nicht-Verwandten-Transplantationen typische hohe Unterschiedlichkeit von Spender und Empfänger HLA-Antigenen (Hoher HLA-Mismatch), Spender-spezifische anti-HLA Antikörper des Empfängers fanden sich jedoch nicht. Die immunsuppressive Therapie nach Nierentransplantation erfolgte in einer üblichen Kombination aus Basiliximab, Tacrolimus, Mycophenolat Mofetil und Steroiden. Zur Therapieüberwachung erfolgte eine strukturierte Nachsorge, darin eingeschlossen regelmäßige Tacrolimus-Spiegelmessungen. Um die Immunsuppression in ihrer biologischen Wirksamkeit neuartig und besser monitorieren zu können, wurde der Patient in die EU-geförderte „TTV-Guide“-Studie eingeschlossen. Durch definierte Messungen der Torque-Teno-Viruslast nach Transplantation erfolgten patientenindividuelle Anpassungen des Tacrolimus-Zielspiegels (siehe Abbildung 1). Um im Zielkorridor der TTV-Viruslast zu bleiben, konnte Tacrolimus verhältnismäßig niedrig dosiert werden. Der postoperative wie auch der längerfristige Verlauf nach Nierentransplantation zeigten sich komplikationslos, unter einer 2-fach Immunsuppression mit Tacrolimus und Mycophenolat Mofetil lag die eGFR zum Monat 12 stabil über 40 ml/min/1,73 m2.
Diskussion zu Fall 1:
Die „TTV-Guide“-Studie – Auf der Suche nach einem Biomarker zur Messung der Stärke einer Immunsuppression
Bislang muss nach jeder Organtransplantation eine lebenslange Immunsuppression verordnet werden. Für die Nierentransplantation ist von besonderem Nachteil, dass Calcineurininhibitoren wie Cyclosporin oder das heutzutage eingesetzte Tacrolimus direkt nephrotoxisch sein können. Eine bestmögliche Dosierung von Immunsuppressiva ist daher existenziell, daher werden regelmäßige Spiegelmessungen durchgeführt. Allerdings erfolgt bislang zumindest am Anfang der Behandlung eine One-size-fits-all Strategie für alle Patienten: Das heißt, alle Patienten starten mit denselben Zielspiegeln. Kommt es im Verlauf zur Abstoßung als Zeichen einer zu geringen Immunsuppression, werden die Zielspiegel individuell erhöht. Kommt es dagegen zu vielen Infektionen als Zeichen einer Überimmunsuppression, so werden die Zielspiegel patientenindividuell reduziert.
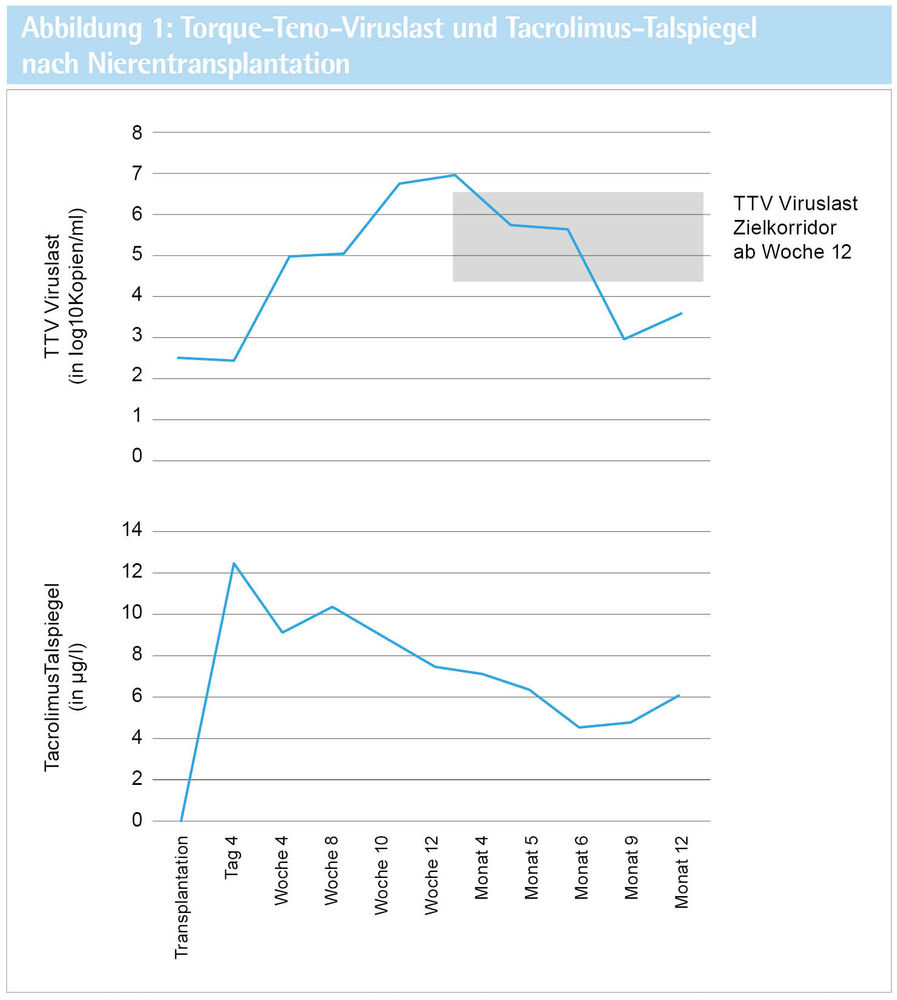
Abb. 1: Bei einem 38-jährigen Patienten erfolgte die Dosierung der Immunsuppression nach Nierentransplantation unter Zuhilfenahme des Biomarkers Torque-Teno-Virus (TTV), der aktuell als neuer Parameter für eine Messung der biologischen Stärke einer Immunsuppression untersucht wird. In diesem Fall reichten niedrige Tacrolimus-Talspiegel aus um den Patienten vor einer Abstoßung des Spenderorgans zu schützen, auch traten keine infektiösen Komplikationen nach Transplantation auf.
Was bislang in der Transplantationsmedizin und auch für andere Erkrankungen, bei denen Patienten immunsupprimiert werden, fehlt, ist eine wirkliche Messung der individuellen biologischen Stärke einer Immunsuppression. Deshalb fördert die Europäische Union das internationale Projekt TTV-Guide (Titel der klinischen Untersuchung: Ein Torque-Teno-Virus basiertes Immunmonitoring). Hintergrund ist, dass die allermeisten Menschen eine gewisse Anzahl von Torque-Teno-Viren (TTV) im Blut haben, ohne dass diese Krankheiten verursachen. Unter einer Immunsuppression steigt die TTV-Viruslast. Voruntersuchungen ergaben Hinweise für einen möglicherweise nach Nierentransplantation idealen TTV-Korridor, bei dem die Immunsuppression nicht zu hoch (also die Patienten keine Infektionen erleiden) und auch nicht zu niedrig ist (und damit kein Risiko für eine Rejektion des Spenderorgans besteht). In der Studie wird diese Hypothese überprüft, und die immunsuppressive Dosierung patientenindividuell so angepasst, dass die TTV-Viruslast in einem vorgegebenen Zielbereich liegt. In der Kontrollgruppe werden Nierentransplantierte konventionell mit Immunsuppressiva behandelt. Mittel- und langfristig wird schließlich untersucht, welche der beiden Gruppen besser abschneidet, Endpunkte der Studie sind Patienten- und Organüberleben bzw. Komplikationen der immunsuppressiven Therapie.
Die Studie wird europaweit in 13 Transplantationszentren von einem internationalen Wissenschaftler-Konsortium unter Federführung der Universität Wien durchgeführt. In Deutschland nehmen die Transplantationszentren Dresden, Berlin und Regensburg teil. Die Rekrutierung der Studie ist mit über 200 Studienteilnehmenden mittlerweile abgeschlossen, erste Ergebnisse werden für das Jahr 2026 erwartet. Weitere Informationen zum Stand und zu Ergebnissen des Projekts finden sich unter www.ttv-guide.eu.
Ein positiver Nebeneffekt der Arbeiten ist, dass die Messung der TTV-Viruslast in allen Studienzentren etabliert wurde und seither in besonderen Fällen auch außerhalb der Studie durchgeführt werden kann.
Fall 2: Antikörper-vermittelte Abstoßung einer Spenderniere
Eine 47-jährige Patientin wurde bei terminalem Nierenversagen aufgrund einer hypertensiven Nephropathie erfolgreich nierentransplantiert. Der unmittelbare postoperative Verlauf war komplikationslos, es kam zur raschen Funktionsaufnahme der Transplantatniere, vier Wochen nach Transplantation war die Transplantatfunktion sehr gut (Kreatinin 1,6 mg/dl, eGFR 38 ml/min/1,73 m2, Albuminurie 160 mg/g Kreatinin). Im weiteren Verlauf kam es jedoch zu einem stetigen Abfall der eGFR auf 24 ml/min/1,73 m2. Eine drei Monate nach Transplantation durchgeführte Biopsie zeigte das Vollbild einer sogenannten Antikörper-vermittelten Abstoßung (antibody-mediated rejection, ABMR). Eine sofort eingeleitete Plasmaaustauschtherapie (PLEX) sowie die Gabe intravenöser Immunglobuline (IVIG) hatte in der kurzfristig durchgeführten Kontrollbiopsie zwar einen vollständigen Rückgang der ABMR gezeigt, dennoch kam es in den Wochen danach bei gleichbleibend schlechter Transplantatfunktion zur deutlichen Zunahme der Albuminurie auf 1.600 mg/g Kreatinin. Eine erneute Biopsie sechs Monate nach Transplantation bestätigte den Verdacht einer Rekurrenz der ABMR.
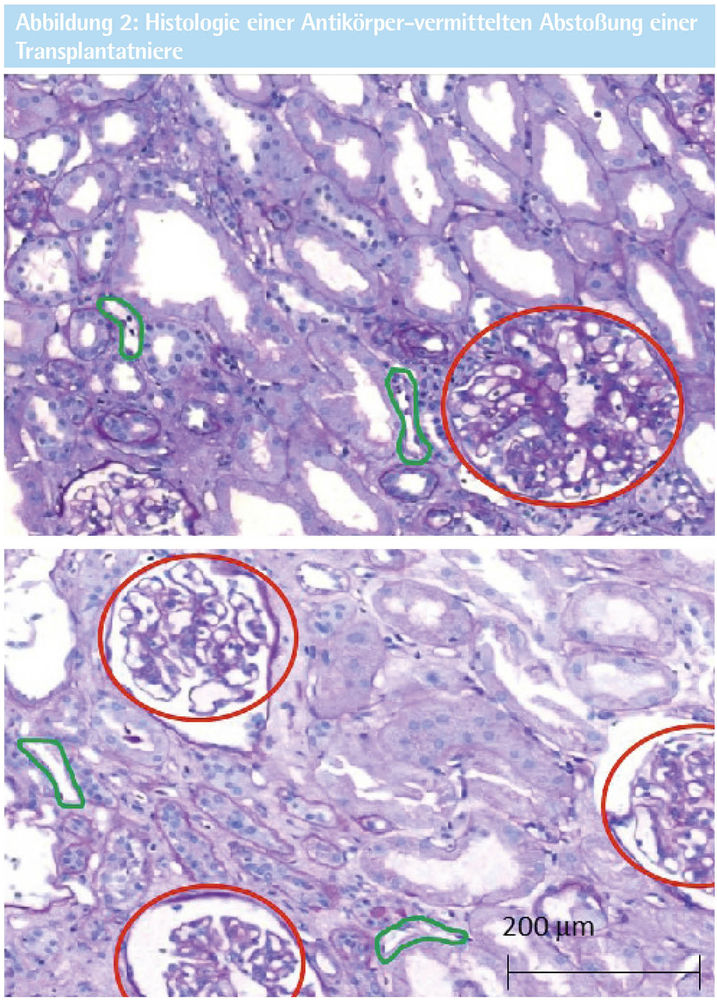
Abb. 2: Nierenbiopsie einer 47-jährigen Patientin mit entzündlich veränderten Nierenkörperchen (Glomerulitis, rote Kreise) und Einwanderung von Entzündungszellen in die peritubulären Kapillaren (Kapillaritis, grüne Umrandungen) der Niere bei Antikörper-vermittelter Transplantatabstoßung (oberes Bild) sowie mit weitgehend unauffälligem Nierengewebe ohne Glomerulitis und peritubuläre Kapillaritis zwei Monate nach Beginn einer Therapie mit Daratumumab (unteres Bild).
Aufgrund des Fehlens zugelassener Therapieoptionen wurde nach Kostengutsprache durch die Krankenkasse im Rahmen eines Off-Label-Use eine Therapie mit dem anti-CD38-Antikörper Daratumumab analog des etablierten Therapieschemas beim Multiplen Myelom begonnen. Zwei Monate nach Beginn der Therapie fand sich bioptisch ein vollständiger Rückgang der ABMR. Nach mittlerweile neun Monaten Therapie ist es erfreulicherweise zur Stabilisierung der Transplantatfunktion (eGFR 28 ml/min/1,73 m2, Albuminurie 150 mg/g Kreatinin) gekommen.
Diskussion zu Fall 2:
Bei über 50 Prozent aller Transplantatversagen finden sich histologisch Zeichen einer ABMR. Eine ABMR tritt bei 10 bis 15 Prozent aller Patienten im ersten Jahr nach einer Nierentransplantation auf und ist auch im Verlauf neben der Non-Adhärenz der größte Risikofaktor für ein verkürztes Transplantatüberleben. Über viele Jahre standen keine wirksamen Therapien gegen die ABMR zu Verfügung. Es ist internationaler Standard, dass bei einer ABMR, die innerhalb von Wochen nach Transplantation auftritt, eine Therapie mit PLEX und IVIG durchgeführt wird. Rationale dieser Therapie ist die Entfernung von gegen das Spenderorgan gerichteter anti-HLA Antikörper (sog. donor-specific antibodies, DSA) durch die Apherese sowie eine Immunmodulation (unter anderem Absättigung von mononukleären Fc-Rezeptoren) durch IVIG. Diese Therapie führt in der Regel im kurzfristigen Verlauf zum Therapieansprechen. Wie bei unserer Patientin kommt es jedoch häufig im Verlauf zur Rekurrenz der ABMR. Für die Behandlung der chronischen bzw. chronisch aktiven ABMR mehrere Monate bis Jahre nach Transplantation standen bislang keine dauerhaft wirksamen Therapien zur Verfügung. Mehrere prospektive Studien der letzten Jahre, die neue Therapieansätze untersucht haben (zum Beispiel IL-6 Blockade durch Cla-zakizumab, Komplement-Blockade durch Eculizumab, Proteasom-Inhibition durch Bortezomib) sind ohne eindeutig positiven Effekt verblieben. Daratumumab ist ein monoklonaler Antikörper gegen das Molekül CD38 auf Plasmazellen und NK-Zellen, und ist aktuell für die Behandlung des multiplen Myeloms zugelassen. Im Kontext einer therapierefraktären, chronisch aktiven ABMR nach Nierentransplantation sind Fallserien publiziert worden, die über ein Therapieansprechen nach Therapie mit Daratumomab bei einem günstigen Sicherheitsprofil berichten konnten. Vor wenigen Monaten wurden die Ergebnisse einer prospektiv randomisierten Phase-2-Studie mit dem anti-CD38-Antikörper Felzartamab zur Behandlung der chronisch aktiven ABMR im New England Journal of Medicine publiziert. Es zeigte sich klinisch, histologisch sowie molekulargenetisch ein beeindruckendes Therapieansprechen in der mit Felzartamab behandelten Gruppe. Auch wenn Vergleichsdaten fehlen, kann angenommen werden, dass der Effekt der beiden anti-CD38-Antikörperpräparate vergleichbar ist. Viele Fragen sind zum jetzigen Zeitpunkt jedoch noch offen. So ist das genaue Therapieschema und insbesondere die optimale Therapiedauer ebenso unklar wie der langfristige Effekt von Daratumumab auf die Transplantatfunktion. Mit einer geplanten retrospektiven Analyse aller bislang in Deutschland und Österreich behandelten Patienten hoffen wir, erste Antworten auf diese Fragen zu erhalten. Ebenso ist eine Phase-3-Studie mit Felzartamab bei Patienten mit chronisch aktiver ABMR in Vorbereitung. Zum jetzigen Zeitpunkt lässt sich aber festhalten, dass mit einer CD38-depletierenden Therapie erstmals ein vielversprechender Ansatz zur Behandlung der ABMR nach Nierentransplantation in Aussicht ist (Abbildung 2).
Fall 3: Aktuelle Limitationen bei Lebendnierentransplantationen
Bei einer 37-jährigen Patientin musste bei terminaler Nierenerkrankung unklarer Ursache drei Monate vor Erstvorstellung an unserem Zentrum eine dauerhafte Nierenersatztherapie mittels Hämodialyse eingeleitet werden. Die Vorstellung erfolgte in Begleitung ihres ebenfalls 37-jährigen Ehemanns zur Evaluation der Möglichkeit einer Nierenlebendspende. Nach einer ersten Sichtung der mitgebrachten Befunde wies der potenzielle Spender keinerlei medizinische Kontraindikationen gegen eine Nephrektomie im Rahmen einer Nierenlebendspende auf. Der Ehemann war sportlich aktiv, es bestanden keinerlei Vorerkrankungen und die mitgebrachte 24-h-Blutdruckmessung zeigte ohne antihypertensive Medikation einen Normalbefund (Mittelwert 112/72 mmHg mit nächtlicher Absenkung). Es konnte darüber hinaus eine uneingeschränkte Nierenleistung (Kreatinin 0,81 mg/dl, eGFR 112 ml/min/1,73m2, keine Albuminurie) dokumentiert werden. Auch hinsichtlich der Blutgruppe bestand Kompatibilität (Blutgruppe O des Spenders auf A bei der Empfängerin). Eine durchgeführte Kreuzprobe zur Evaluation der immunologischen Kompatibilität zwischen dem potenziellen Spender und der Empfängerin war negativ. Allerdings fanden sich im deutlich sensitiveren Luminex anti-HLA-Antikörpertest bei der Empfängerin mehrere, gegen den Spender gerichtete, anti-HLA-Antikörper mit hoher Teststärke. Die Patientin hatte sich mutmaßlich im Rahmen der mehrere Jahre zurückliegenden Schwangerschaft mit der gemeinsamen Tochter gegen die Gewebemerkmale (HLA) des Ehemanns immunisiert. Eine HLA-inkompatible Nierentransplantation gegen diese sogenannten paternalen Antikörper wäre mit einem deutlich erhöhten Risiko einer frühen ABMR und einem verkürzten Transplantatüberleben verbunden, weshalb dem Ehepaar letztlich trotz der ansonsten sehr guten Eignung des Ehemanns von einer Lebendnierentransplantation abgeraten werden musste.
Diskussion zu Fall 3:
Um die Freiwilligkeit einer Nierenlebendspende sicherzustellen, hatte man bei Inkrafttreten des Transplantationsgesetzes (TPG) 1997 dem möglichen Spenderkreis enge Grenzen gesetzt. Eine Nierenlebendspende war bislang nur zwischen Verwandten ersten oder zweiten Grades, Ehegatten, eingetragenen Lebenspartnern, Verlobten oder anderen Personen, die dem Empfänger in besonderer persönlicher Verbundenheit offenkundig nahestehen, erlaubt (§ 8 Abs. 1 TPG). Wenn, wie in unserem Fall, eine Nierenlebendspende aus immunologischen Gründen nicht möglich ist, bedeutet dies für Betroffene bislang, im Durchschnitt acht bis zehn Jahre auf ein postmortales Spenderorgan zu warten. Die engen Grenzen bei der Spenderauswahl haben es bislang unmöglich gemacht, in diesen Fällen sogenannte Überkreuzspenden zwischen zwei oder mehr immunologisch kompatiblen Spender-Empfängerpaaren durchzuführen, wie es international schon lange Standard ist.
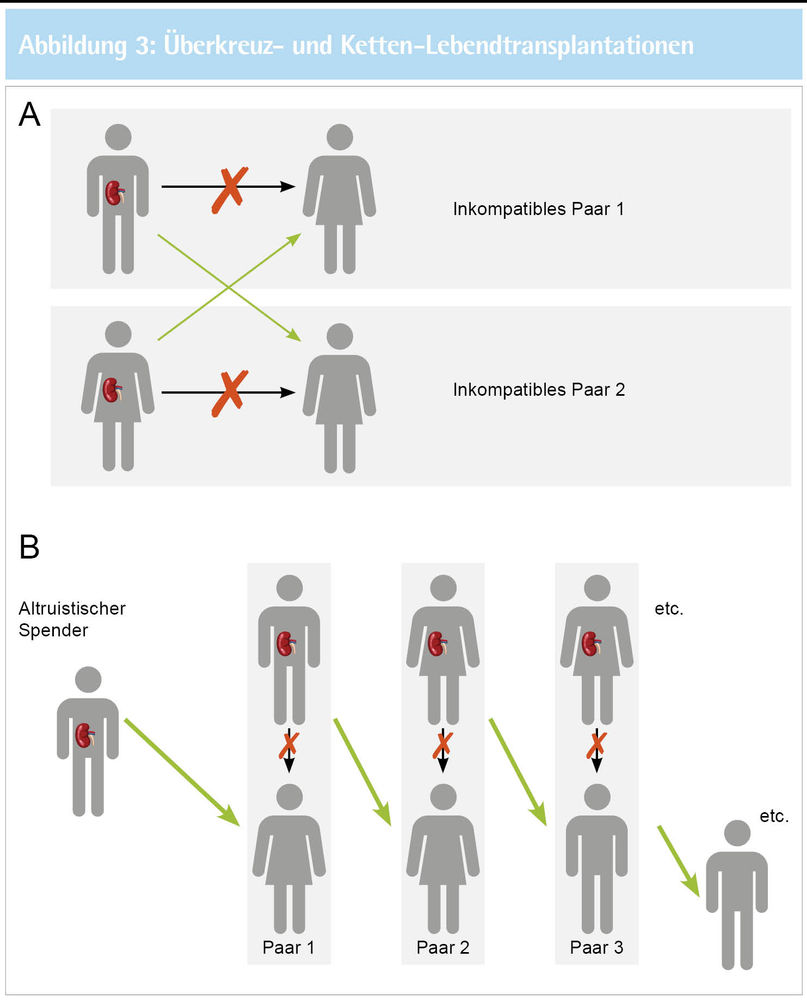
Abb. 3: Überkreuz-Lebendspende. Bei Inkompatibilität zwischen zwei Spender-Empfänger-Paaren kann der Austausch der Spender zur kompatiblen Nierenspende beider Empfänger führen (A). Kettenspende durch altruistische Spende. Ein altruistischer Spender kann durch seine Spende eine Vielzahl kompatibler Spenden ermöglichen (B).
Der Deutsche Bundestag hat hier den lange bestehenden Reformbedarf erkannt und im Sommer 2024 einen Gesetzentwurf zur Neuregelung der Nierenlebendspende auf den Weg gebracht. Neben der Einführung eines nationalen Programms für die Überkreuzlebendspende, das auch die Möglichkeit der nicht-gerichteten altruistischen Spende mit einschließt, soll der gesetzliche Rahmen der Lebendspende neu geregelt werden. Hierbei soll zum einen der Spenderschutz durch umfassende Aufklärungs- und psychosoziale Beratungsmaßnahmen noch weiter gestärkt werden, zum anderen soll das sogenannte Subsidiaritätsprinzip aufgehoben werden. Bislang musste nachgewiesen werden, dass zum Zeitpunkt der Nierenlebendspende kein postmortales Organ für Betroffene zur Verfügung steht. Da jedoch nur terminal nierenkranke Menschen in Deutschland auf die Wartelisten aufgenommen werden können, war eine Lebendnierentransplantation vor Erreichen der Dialysepflichtigkeit (eine sogenannte präemptive Transplantation), die für Betroffene einen nachgewiesen deutlichen Überlebensvorteil mit sich bringt, vom Gesetz nicht vorgesehen.
Letztlich soll im Rahmen der Neuregelung auch die Möglichkeit geschaffen werden, ehemalige Nierenspender, die im Laufe ihres Lebens selbst eine Nierentransplantation benötigen, mit einem Bonus zu kürzeren Wartezeiten zu verhelfen. Eine solche Regelung besteht in vielen anderen Ländern und stellt eine dringend gebotene Kompensation für schicksalshafte Einzelfälle dar.
Das Wichtigste in Kürze
» In Deutschland werden jährlich rund 1.500 postmortale Nierentransplantationen und 600 Lebendnierentransplantationen durchgeführt.
» Von 100.000 Dialysepatienten sind deutschlandweit nur noch 6.500 zur Transplantation gelistet, dennoch beträgt die durchschnittliche Wartezeit in Bayern im Normalverfahren mehr als neun Jahre und im Eurotransplant-Senior-Programm fünf Jahre.
» Neue wissenschaftliche und klinische Erkenntnisse haben das Potenzial, sehr bald Eingang in die klinische Routine zu finden.
» Derzeit wird geprüft, ob über den Einsatz des Biomarkers Torque-Teno-Virus (TTV) die immunsuppressive Therapie nach Nierentransplantation besser und patientenindividuell gesteuert werden kann.
» Ein Großteil der Transplantatorgane geht langfristig weiterhin durch eine chronische Rejektion verloren.
» Während zelluläre Abstoßungen in der überwiegenden Zahl der Fälle gut therapierbar sind, gibt es bislang kaum evidenzbasierte Strategien für antikörpervermittelte Rejektionen. Ein neuer Therapieansatz lässt hoffen, dass antikörpervermittelte Abstoßungsreaktionen zukünftig behandelbar werden.
» Eine Fortschreibung des Transplantationsgesetzes wird künftig die Durchführung von Lebendorganspenden neu regeln. Auch in Deutschland werden dann altruistische Nierenspenden, Überkreuz- und Ketten-Nierentransplantationen möglich. Oberstes Gebot bleibt weiterhin ein bestmöglicher Schutz des Lebendspenders.
Die Abteilung für Nephrologie des Universitätsklinikums Regensburg wird für die Teilnahme an der TTV-Guide-Studie von der Europäischen Union gefördert, Interessenkonflikte bestehen nicht.
Bilder freundlicherweise zur Verfügung gestellt von Professorin Dr. Maike Büttner-Herold, Abteilung für Nephropathologie, Universitätsklinikum Erlangen.
Das Literaturverzeichnis kann im Internet unter www.bayerisches-aerzteblatt.de (Aktuelles Heft) abgerufen werden.
Autoren

Professor Dr. Daniel Zecher 1, 2

Professor Dr. Bernhard Banas, MBA 1, 2
1 Abteilung für Nephrologie und
2 Universitäres Transplantationszentrum
Universitätsklinikum Regensburg, 93042 Regensburg
Teilen:
Das könnte Sie auch interessieren:






