Die Inzidenz des sekundären Armlymphödems nach Mammakarzinom wird je nach Studie mit 14 bis 22 Prozent angegeben, wobei das Risiko nach axillärer Lymphadenektomie mit zusätzlicher Bestrahlung am höchsten ist und eine Inzidenz von 31 Prozent zeigt [1, 2]. Bei den meisten Patientinnen manifestiert sich ein Lymphödem in den ersten zwei Jahren nach der chirurgischen Behandlung [1], es kann aber auch erst zu einem deutlich späteren Zeitpunkt in Erscheinung treten.
Die Möglichkeiten der rekonstruktiven Lymphchirurgie haben in der Behandlung des Lymphödems in den vergangenen Jahren einen immer größer werdenden Stellenwert eingenommen. Hier zu nennen sind insbesondere die lymphovenösen Anastomosen (Abbildung 2), welche einen direkten Abfluss der Lymphe ins Venensystem ermöglichen, und die freie mikrovaskuläre Lymphknotentransplantation (Abbildung 3). Eine Vielzahl an Studien hat gezeigt, dass dadurch nicht nur das Extremitätenvolumen langfristig reduziert werden kann, sondern auch die Kompressionsversorgung und Frequenz der manuellen Lymphdrainage [3, 4, 5]. Zudem profitieren die Patienten von einer besseren Lebensqualität und Funktion der betroffenen Extremität [4]. Die genannten Operationsverfahren können als selbstständige Eingriffe zur Behandlung des primären und sekundären Bein- oder Armlymphödems durchgeführt werden oder in Kombination mit einer autologen Brustrekonstruktion (Abbildung 1). Hier zu nennen sei auch die in den letzten Jahren steigende Bedeutung robotisch-assistierter mikrochirurgischer Operationen, welche ein minimal-invasives Vorgehen bei höchster Präzision ermöglichen [6 bis 10]. So kann beispielsweise durch die Verwendung des Da-Vinci-Robotersystems bei der Hebung des DIEP-Lappens das Ausmaß der Bauchwandfaszieninzision minimiert werden, was wiederum die Morbidität des Eingriffes im Hinblick auf die Integrität der Bauchwandmuskulatur deutlich reduziert [11].
Neu in der Plastischen Chirurgie
 Neu in der Plastischen Chirurgie
Neu in der Plastischen Chirurgie
In der plastischen, rekonstruktiven und ästhetischen Chirurgie wurden in den letzten Jahren bedeutende Fortschritte gemacht. Dadurch wurden die Behandlungsmodalitäten, erzielbare Ergebnisse und damit die Lebensqualität der Patientinnen/Patienten deutlich verbessert. Wir möchten im folgenden Beitrag exemplarisch verschiedene innovative Therapieoptionen vorstellen. So entwickeln einige Patienten trotz immer schonenderer onkologischer Operationsmethoden aufgrund notwendiger Lymphknotenresektionen postoperative Lymphödeme, welche mit einer deutlichen Morbidität einhergehen; diese können durch mikrochirurgische Rekonstruktionen der Lymphbahnen erfolgreich therapiert werden. Im Bereich der Handchirurgie können moderne Daumensattelgelenksprothesen bei Patienten mit fortgeschrittener Rhizarthrose eine Schmerzreduktion und funktionale Wiederherstellung ermöglichen. Auch die moderne Verbrennungsbehandlung basiert auf technologischen Neuerungen. Enzymatische Débridements entfernen verbranntes und nekrotisches Gewebe vollständig, aber gleichzeitig gewebsschonend. Synthetische Materialien fungieren als temporärer Hautersatz und fördern die Wundheilung, während die Kaltplasmatherapie durch ihre antimikrobiellen Eigenschaften zu einer deutlichen Keimreduktion beitragen kann.
Fall 1: Brustrekonstruktion mit Eigengewebe und gleichzeitiger Lymphknotentransplantation
Eine 56-jährige Patientin stellte sich mit einer schmerzhaften Kapselfibrose der linken Brust sowie einem Lymphödem des linken Armes im Stadium I vor. Die Patientin hatte fünf Jahre zuvor eine Mastektomie mit Prothesenbasierter Rekonstruktion der linken Brust sowie eine Lymphadenektomie der linken Axilla mit anschließender Radiotherapie bei multizentrischem Mammakarzinom erhalten. In der körperlichen Untersuchung zeigte sich eine verhärtete und deformierte Brust als Ausdruck der fibrotischen Implantatkapsel. Neben dem ausgeprägten Ödem von Ober- und Unterarm, bestand eine Bewegungseinschränkung in der linken Schulter, welche durch eine kontrakte Narbe in der Axilla verursacht wurde.
In Anbetracht des hohen Risikos einer erneuten Kapselfibrose bei alleinigem Implantatwechsel und dem bereits manifesten Lymphödem, erfolgte eine Rekonstruktion der linken Brust mittels freier DIEP (deep inferior epigastric perforator) – Lappenplastik und gleichzeitiger Transplantation von Lymphknoten aus der Leistenregion (Abbildung 1). Zur Rekonstruktion des Lymphabflusses wurden nach Entfernung der Vernarbungen, die Lymphknoten mit einem zusätzlichen Gefäßanschluss in die Axilla transplantiert. Im postoperativen Verlauf zeigte sich neben einem ästhetisch zufriedenstellenden Resultat der rekonstruierten Brust, eine erfreuliche Reduktion der Ödemneigung sowie eine uneingeschränkte Beweglichkeit des linken Armes. Die Patientin konnte sechs Monate postoperativ die Kompressionsklasse des Kompressionsärmels reduzieren und die manuelle Lymphdrainage vorerst pausieren.
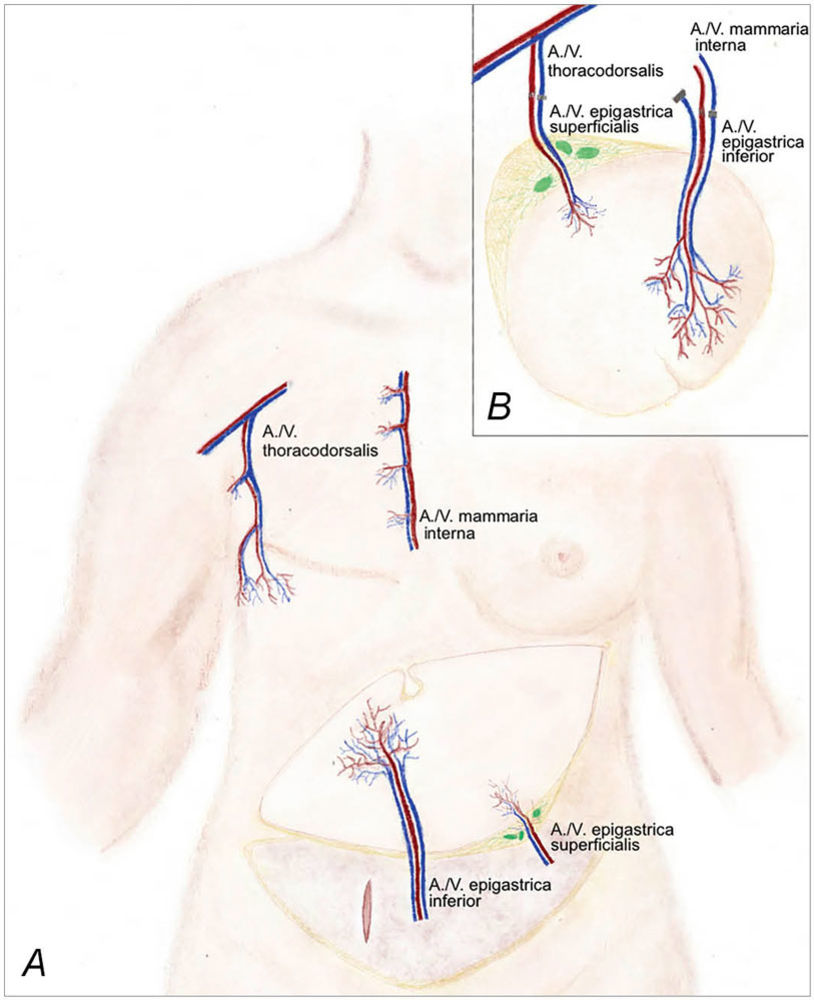
Abbildung 1: (A) Schematische Darstellung einer freien DIEP-Lappenplastik (Gefäßstiel: A./V. epigastrica inferior) unter Mitnahme von Lymphknoten entlang der oberflächlichen epigastrischen Gefäße (A./V. epigastrica superficialis). (B) Mikrovaskulärer Gefäßanschluss der DIEP-Lappenplastik an die A./V. mammaria interna. Die Transplantation der Lymphknoten (grün) in die Axilla erfolgt durch einen zusätzlichen Gefäßanschluss an die A./V. thoracodorsalis.
Die Operation erfolgt im Rahmen eines stationären Aufenthaltes von ca. fünf bis sieben Tagen. Nach der Operation müssen die Patientinnen einen Bauchgurt für sechs Wochen tragen. Zudem sollte die etablierte Entstauungstherapie (Lymphdrainage und Kompressionsärmel) zunächst über einen Zeitraum von drei Monaten fortgeführt werden.
Hintergrund
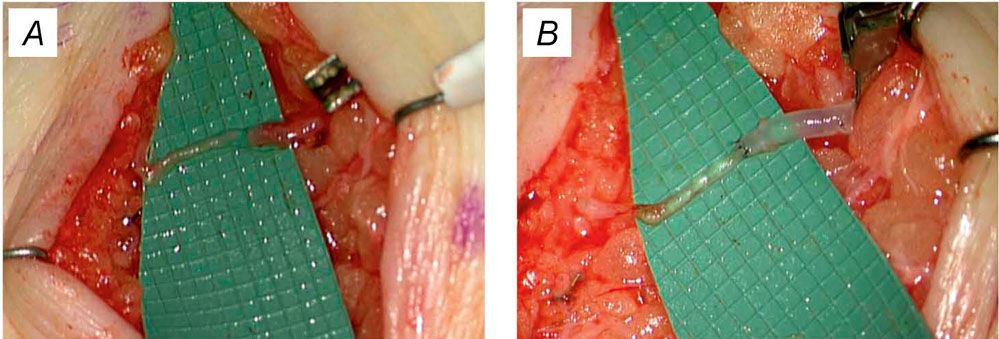
Abbildung 2: (A) Lymphgefäß (0,7 mm links) und Vene (1,2 mm rechts). (B) Die genähte lymphovenöse Anastomose zeigt einen Abfluss von Lymphe ins Venensystem [12].
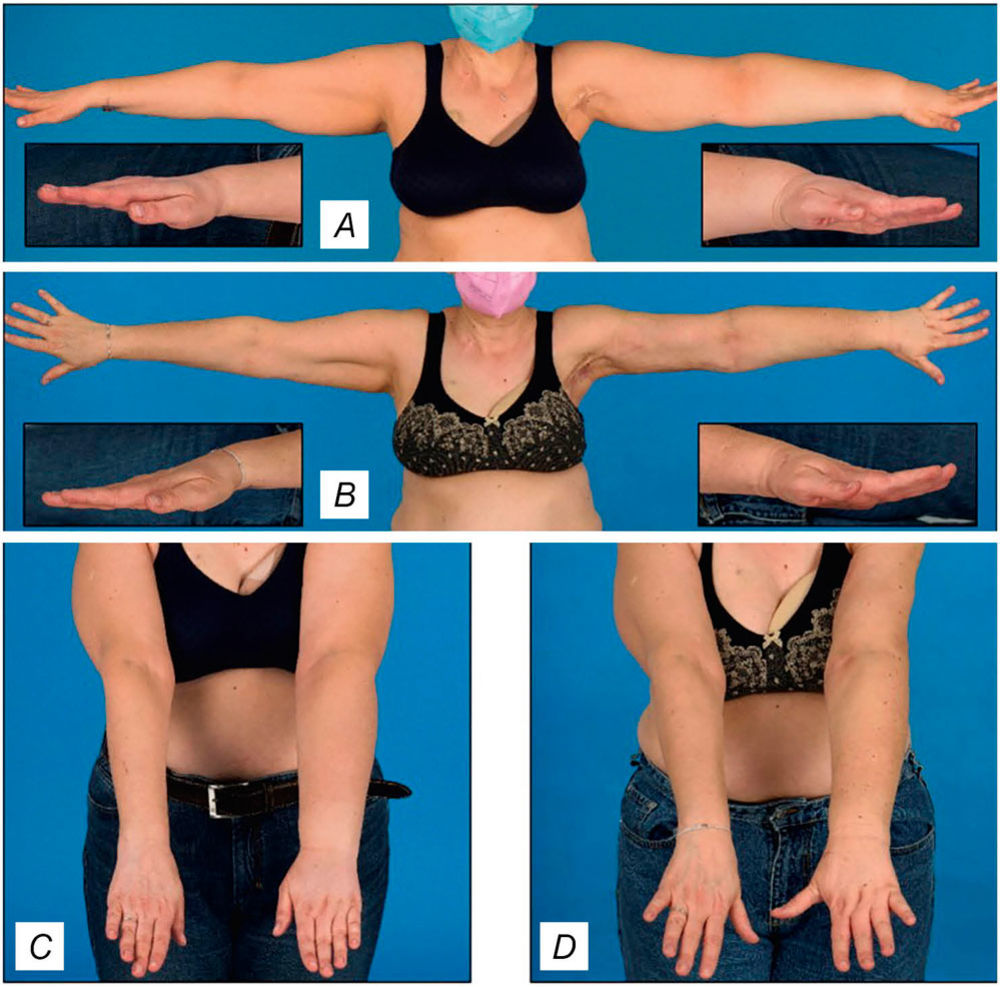
Abbildung 3: (A und C) Präoperatives Bild, das ein Lymphödem des linken Arms zeigt. Die Schwellung der dorsalen linken Hand und des linken Unterarms ist im Vergleich zur kontralateralen Seite deutlich sichtbar (linke und rechte Bildeinschübe). (B und D) Drei Monate nach freier mikrovaskulärer Lymphknotentransplantation in die linke Achsel, einer lymphovenösen Anastomose und geringen Liposuktion am Unterarm zeigt die Patientin einen deutlichen Rückgang des Lymphödems. Vor allem der distale linke Unterarm und die Hand weisen im Vergleich zur kontralateralen Seite eine deutlich geringere Schwellung auf (linke und rechte Bildausschnitte) [13].
Fazit
Patienten nach rekonstruktiver Lymphchirurgie profitieren langfristig von einer besseren Lebensqualität und reduzierten Symptomen, was diese Operationsverfahren zu einem wichtigen Bestandteil moderner Behandlungskonzepte macht. In Anbetracht eines in der Regel über die Jahre progredienten Lymphödems und des hohen Risikos nach stattgehabter Lymphadenektomie sollte bei geplanter Brustrekonstruktion frühzeitig eine gleichzeitige Lymphknotentransplantation evaluiert werden.
Fall 2: Daumensattelgelenksarthrose
Ein 53-jähriger Patient stellt sich in unserer Sprechstunde mit belastungsabhängigen Schmerzen und Kraftverlust bei Tätigkeiten mit dem linken Daumen vor. Vor allem das Öffnen von Flaschen oder der Haustür und Auswringen von Haushaltslappen seien kaum noch ohne Schmerzen möglich.
In der Vergangenheit erfolgte bereits eine durchgeführte intermittierende Ruhigstellung in einer Daumenorthese, Analgesie und zweifache Infiltrationen mittels Kortison-Lokalanästhetikum-Gemisch im niedergelassenen Setting. An der rechten Hand erfolgte bereits vor vier Jahren eine Resektions-Suspensions-Arthroplastik (RSA) bei Rhizarthrose Stadium III. Hierbei wird ein Handwurzelknochen „Os trapezium“ entfernt und der Daumen durch einen „halbierten“ Sehnenstreifen zusätzlich stabilisiert.
Bei Schmerzprogredienz wünschte der Patient nun eine weiterführende Beratung durch uns. Radiologisch präsentierte sich eine Rhizarthrose Stadium III nach Eaton/Littler (siehe Tabelle 2). Nach ausführlicher Aufklärung über die oben genannten Behandlungsmethoden fiel die Wahl des Patienten auf die Sattelgelenksprothese.
Nach initialer Ruhigstellung konnte bereits nach zwei Wochen unter handtherapeutischer Mobilisation mit Übungen begonnen werden, nach sechs Wochen konnte der Patient schmerzfrei Tätigkeiten im Alltag durchführen. Das Video (QR-Code unten) zeigt die freie Beweglichkeit (links nach Implantation der Sattelgelenksprothese sechs Wochen nach Operation, rechts vier Jahre nach Resektions-Suspensions-Arthroplastik).
Hintergrund
Durch den teilweise hochintensiven Einsatz unserer Hände in Beruf und Freizeit, sind die einzelnen Strukturen unterschiedlichen Kräften ausgesetzt, die Folge können unter anderem Schmerzen und Funktionseinschränkungen sein. Sowohl die Fingergelenke als auch das Daumensattelgelenk sind sehr häufig von Arthrose betroffen (Nomenklatur, siehe Tabelle 1 und Abbildung 4) [4 bis 7]. Durch moderne handchirurgische Behandlungsformen kann heute die Versteifung der Gelenke meist vermieden und Schmerzfreiheit mit guter Beweglichkeit erreicht werden [4].
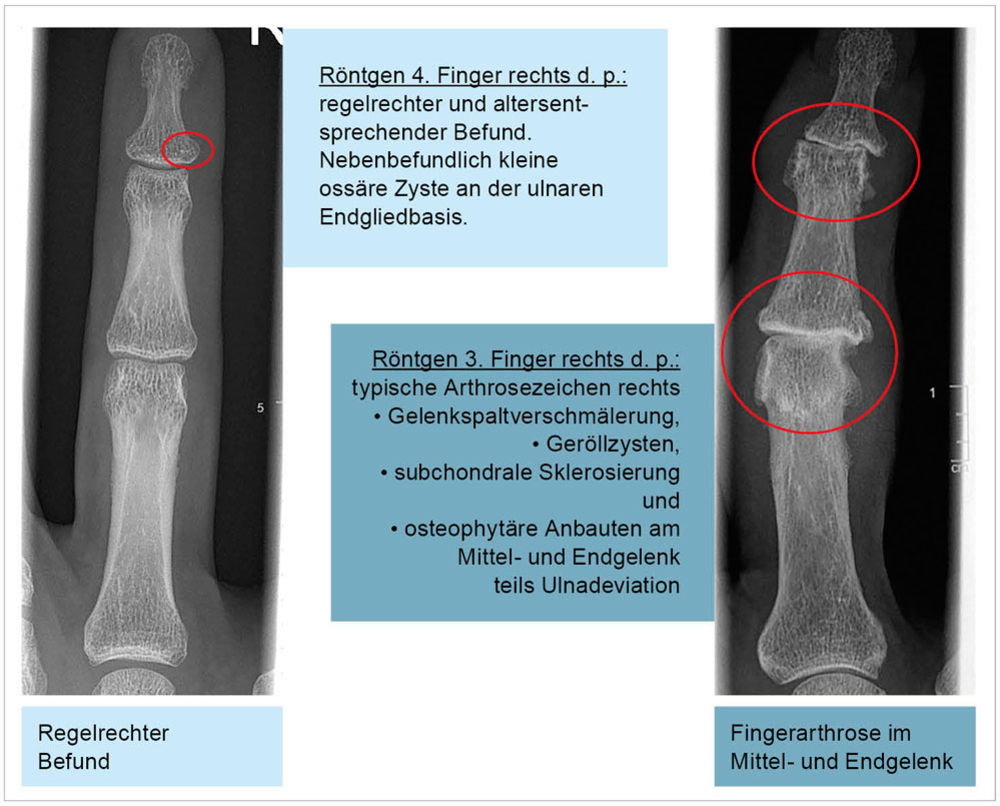
Abbildung 4: Röntgenbefunde bei Arthrose am Finger (Normalbefund versus Arthrose).
Während bei Fingergelenksarthrosen (an den Mittel- und Grundgelenken) bereits seit Jahrzehnten Fingerprothesen als beweglichkeitserhaltende Operation zum Einsatz kommen, wurden Implantate am Daumensattelgelenk aufgrund von schlechten Erfahrungen im deutschsprachigen Raum in der Vergangenheit immer wieder kritisch gesehen [5, 6, 7].
Doch der handchirurgische Alltag wurde in den letzten Jahren speziell durch die Einführung der neuesten Generation von Daumensattelgelenksprothesen (siehe Abbildung 5 und 6) verändert. Diese „neuen“ Prothesentypen werden bereits in Belgien und Frankreich seit ungefähr einem Jahrzehnt verwendet. Jetzt deutet sich auch im deutschsprachigen Raum eine Trendwende in der Behandlung der Daumensattelgelenksarthrose (= Rhizarthrose) an [8, 9]. Dabei gibt es bereits seit vielen Jahren handchirurgische Kolleginnen und Kollegen in Deutschland, die sehr erfolgreich mit den neueren Generationen von Sattelgelenksprothesen arbeiten [12].
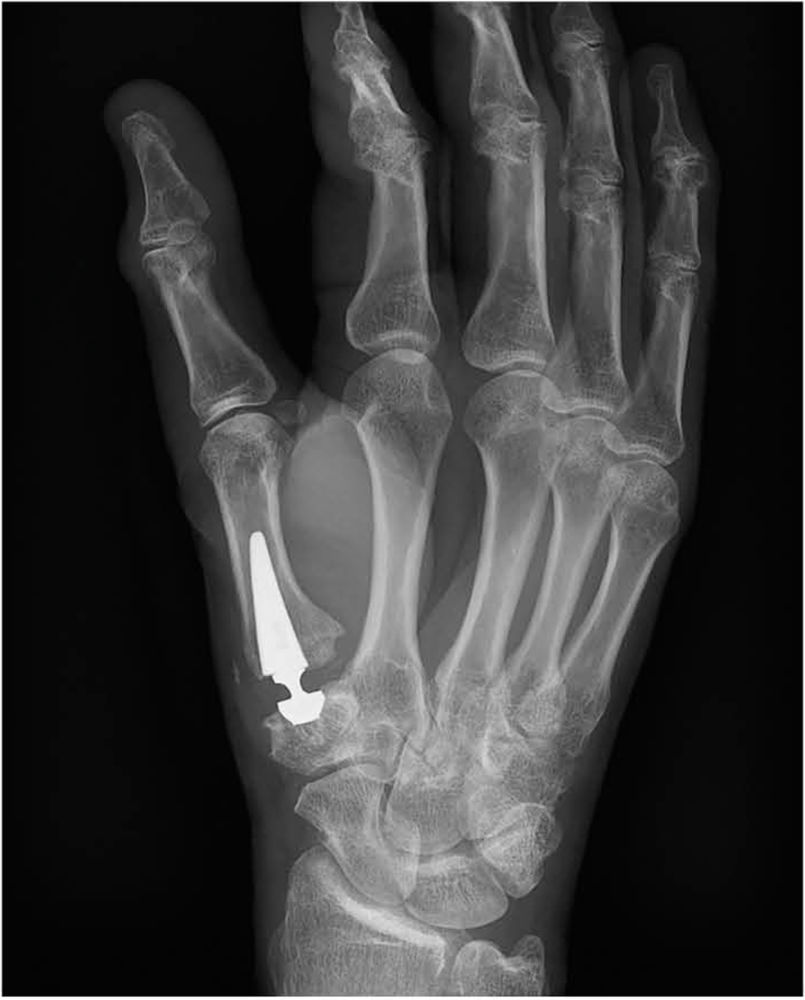
Abbildung 5: Implantation einer Daumensattelgelenks (DSG)-Prothese der dritten Generation
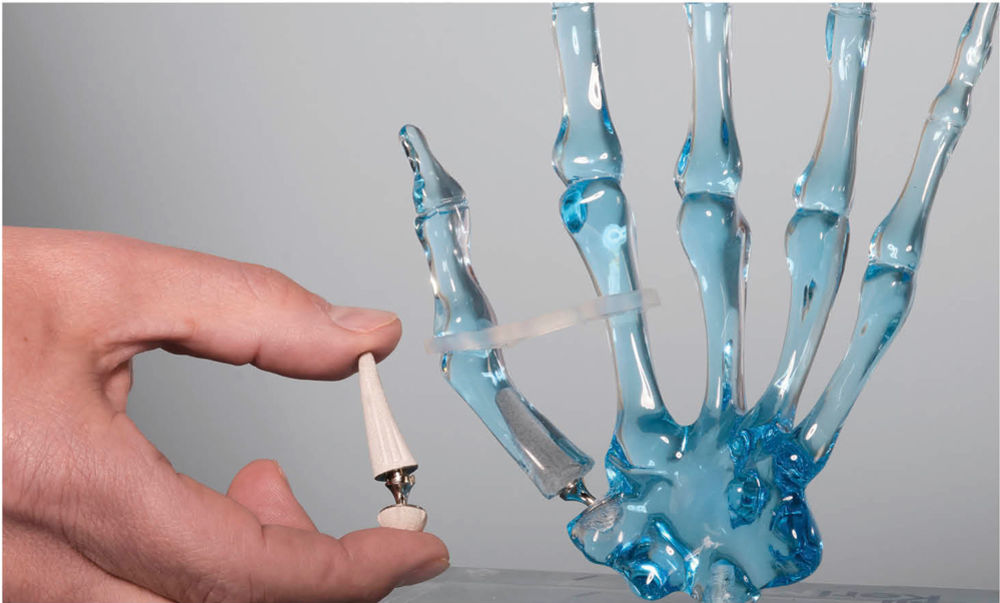
Abbildung 6: DSG-Prothese im Modell.
Bereits 1971 erfolgten die ersten Implantationen von Sattelgelenksprothesen, neuere Modellvarianten kamen im Laufe der Jahrzehnte hinzu, von denen aber immer wieder aufgrund von höheren Komplikationsraten Abstand genommen wurde, kurzum die Biomechanik der Hand ist sehr komplex [13].
Was ist also neu an der „Trendwende“ der „Mini-Hüfte“ für die Hand?
Die Endoprothesen in den aktuellen Generationen, die modular aufgebaut und mit bipolaren Köpfen versehen sind, bieten vielversprechende Ergebnisse im europäischen Raum mit überzeugenden 10-Jahresergebnissen gegenüber den klassischen Operationsmethoden (wie Resektions-/Suspensions-Arthroplastik) im Hinblick auf eine schnellere Regenerationszeit, geringe postoperative Schmerzen, schnelle Wiedereingliederung in den Alltag, und vor allem, die Option, die klassischen Operationstechniken trotz bestehender Sattelgelenksprothese im Verlauf ausführen zu können, sollten Komplikationen wie Lockerungszeichen auftreten. Dabei sollen laut Jung et al. (2013) bei Versagen der Prothesen dennoch ordentlich funktionelle Ergebnisse möglich sein [14, 15].
Der aktuellen Studienlage nach, liegt die Komplikationsrate für die Sattelgelenksprothesen im deutschsprachigen Raum bei unter fünf Prozent für 5-Jahresergebnisse, im französischsprachigen Raum für 10-Jahresergebnisse bei < zehn Prozent. Wirft man einen Blick zu unseren französischsprachigen Nachbarn, beträgt die Standzeit der Prothesen
ca. zehn Jahr [13, 16 bis 20].
Nach zwölf Monaten zeigen sich bei beiden Operationstechniken (Prothese vs. Resektions-/Suspensions-Arthroplastik) annähernd ähnliche Ergebnisse. Die neueren Prothesenmodelle punkten mit signifikant besseren Ergebnissen bezüglich Kraft und Beweglichkeit [18, 19, 20].
Trotz dieser sehr positiven Ergebnisse für die Daumensattelgelenksprothese ist eine zuverlässige Aussage aufgrund von fehlenden vergleichbaren Langzeitstudien und aber auch aufgrund der geringen Patientenanzahl im Vergleich zur Endoprothetik bei Knie- und Hüftoperationen noch nicht möglich.
Inwieweit sich die Daumensattelgelenksprothese zu einem medizinischen Fortschritt bei der Rhizarthrose entwickelt, werden weitere Langzeitbeobachtungen mit einem Implantateregister zeigen müssen, so wie es in der Hüft- und Knieendoprothetik bereits seit vielen Jahren der Fall ist [24, 25].
Bis dahin sollten die Patienten über beide vorhandenen Techniken ausführlich aufgeklärt werden, sodass eine endgültige Entscheidung für ein Verfahren durch den Patienten selbst getroffen werden kann.
Fazit
Noch vor einigen Jahren wurde Patienten mit einer Rhizarthrose bei entsprechender Eignung eine klassische Operationsmethode als Goldstandard angeboten. Der Trend heute zeigt, die Prothese ist mindestens gleich auf. Inwieweit auch der wirtschaftliche Druck eine Rolle spielt, ist nicht sicher zu klären.
Patienten, die für eine Prothese bei strenger Indikationsstellung und Abwägung in Frage kommen, sollten von den guten Ergebnissen in Zukunft profitieren können.
Fall 3: Verbrennungsbehandlung
Ein 55-jähriger Patient wurde bei einer Verbrennung zweiten bis dritten Grades axillär links stationär aufgenommen. Es erfolgte eine zeitnahe Nekrektomie mit anschließender Deckung mit Spalthaut. Aufgrund im Verlauf erhöhter Entzündungsparameter wurde bei klinischer Wundinfektion mit schmierig belegter Wunde und auffälligem Odor eine intravenöse Antibiotikatherapie eingeleitet. Begleitend erfolgte eine lokale Kaltplasmatherapie, worunter es rasch zu einer deutlichen Besserung und stabilen Wundverhältnissen kam (Abbildung 7).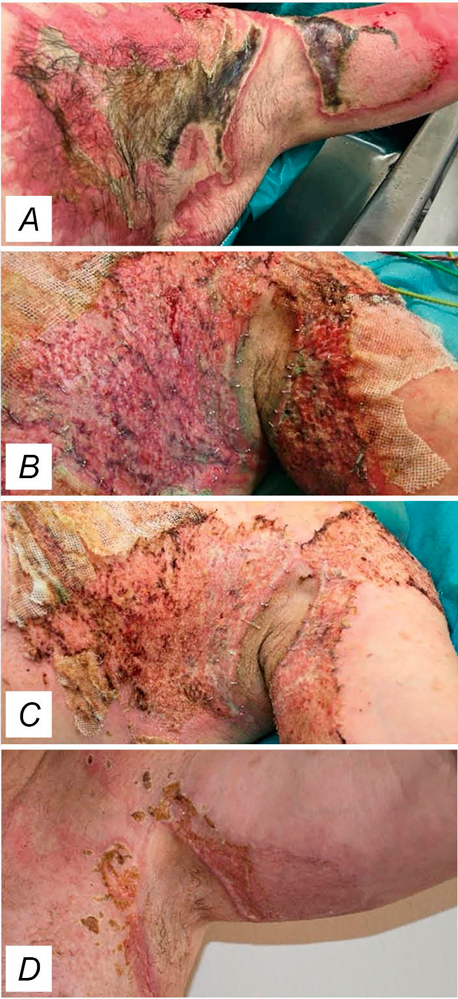
Abbildung 7:
A: 55 Jahre alter Patient mit drittgradiger Verbrennung axillär links; Zustand vor Nekrektomie.
B: Bei dem ersten Verbandswechsel fünf Tage nach der Spalthauttransplantation präsentiert sich die Wunde deutlich mazeriert, belegt bei auffälligem Odor. Bei Anstieg der Entzündungszeichen Einleitung einer intravenösen Antibiose.
C: Nach begleitend mehrmaligen Kaltplasma-Anwendungen zeigt sich weitere vier Tage später eine deutliche Besserung des Lokalbefunds.
D: Etwa 14 Tage nach Einleitung der Kaltplasmabehandlung zeigt sich eine erfreuliche Heilungstendenz.
Hintergrund
Verbrennungen und Verbrühungen sind häufige, aber oft unterschätzte Verletzungen, die aus alltäglichen Situationen resultieren können. Glücklicherweise sind die betroffenen Areale meist klein und die Verletzungen überwiegend oberflächlich.
Alloplastische Membranen aus biokompatiblen Polymeren auf Polylactidbasis haben sich in den letzten Jahren zu einem weitgehend akzeptierten Standard für den temporären Hautersatz etabliert (siehe Abbildung 8). Sie werden bei oberflächlichen bis tieferen Verbrennungen (Grad 2a, kleinflächig auch Grad 2b bis Grad 3, vgl. Tabelle 3) eingesetzt, verbleiben auf der zuvor gereinigten Wundfläche und lösen sich mit Abschluss der Reepithelisierung schmerzfrei ab. Während der langsamen Degradation wird kontinuierlich Lactat frei, was den pH-Wert der Wunde reguliert und so die Regeneration des Wundgewebes fördert. Zu den wesentlichen Vorteilen gehören eine signifikante Schmerzreduktion bei einem verringerten Bedarf an Verbandswechseln; auch zeigt sich bei dem Behandlungsverfahren ein reduziertes Infektionsrisiko sowie eine geringere Notwendigkeit von Hauttransplantationen. Allergische Reaktionen sind nicht bekannt [1, 2].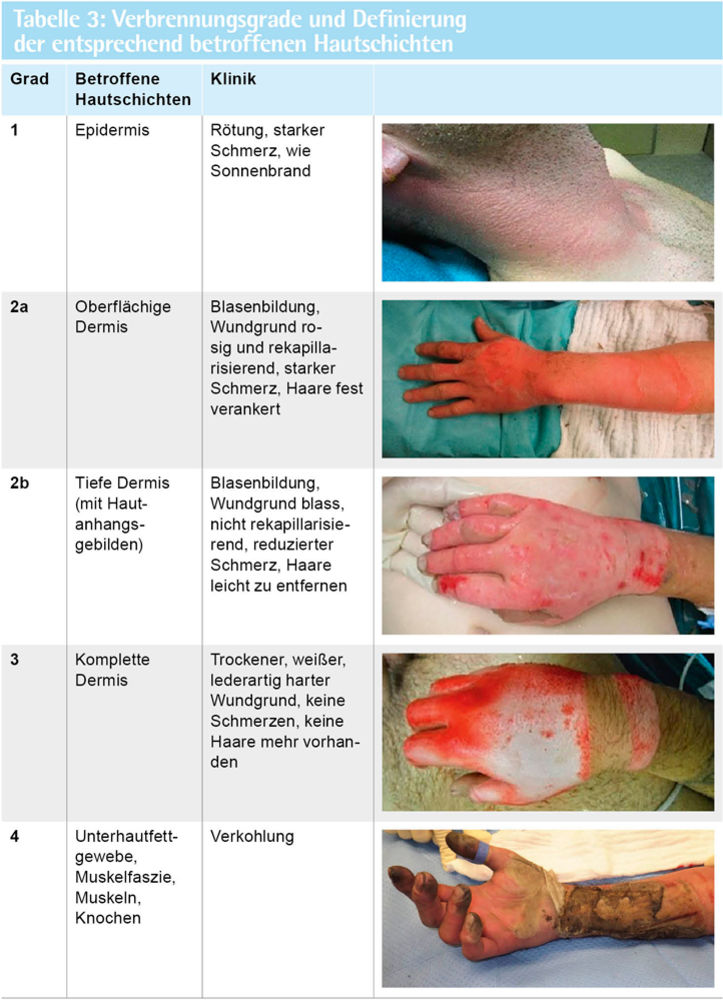
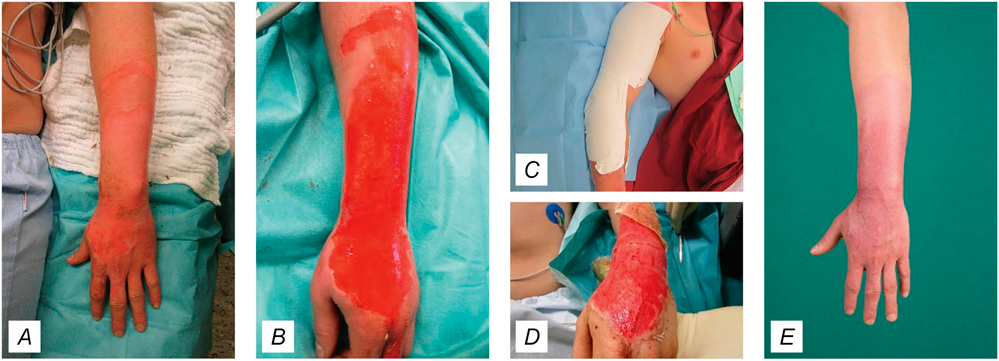 Abbildung 8: Behandlung mit einer alloplastischen Membran. (A). 2a°-Verbrennung von Handrücken und Unterarm. (B) Nach dem Débridement zeigt sich ein gut durchbluteter Wundgrund, sodass ein Verband mit einer alloplastischen Membran angelegt werden kann. (C) Die weißen Sheets sind schon kurze Zeit nach Verbandsanlage nicht mehr sichtbar, da sie mit dem Wundsekret zu einem transparenten Verband verschmelzen. Ein zusätzlicher Schutz erfolgt durch Fettgazen. (D) Sobald eine Reepithelisierung stattgefunden hat, lassen sich die Fettgazen gut ablösen. (E) Nach zwei Wochen zeigt sich eine abgeschlossene Reepithelisierung.
Abbildung 8: Behandlung mit einer alloplastischen Membran. (A). 2a°-Verbrennung von Handrücken und Unterarm. (B) Nach dem Débridement zeigt sich ein gut durchbluteter Wundgrund, sodass ein Verband mit einer alloplastischen Membran angelegt werden kann. (C) Die weißen Sheets sind schon kurze Zeit nach Verbandsanlage nicht mehr sichtbar, da sie mit dem Wundsekret zu einem transparenten Verband verschmelzen. Ein zusätzlicher Schutz erfolgt durch Fettgazen. (D) Sobald eine Reepithelisierung stattgefunden hat, lassen sich die Fettgazen gut ablösen. (E) Nach zwei Wochen zeigt sich eine abgeschlossene Reepithelisierung.
Bei tiefen Verbrennungen ist eine zeitnahe chirurgische Nekrektomie weiter der Goldstandard, birgt jedoch aufgrund der Invasivität des Eingriffs das Risiko von erhöhten Blutverlusten und teilweise unnötigen Narben bzw. Funktionseinbußen. Als schonende Alternative wurde das enzymatische Débridement mit Bromelain (siehe Abbildung 9), das aus dem Stamm der Ananas gewonnen wird, und avitales, nekrotisches Gewebe selektiv entfernt, in die S2k-Leitline zur Verbrennungsbehandlung bei Erwachsenen aufgenommen [3, 4]. Darüber hinaus trägt das enzymatische Débridement zur Reduzierung der erforderlichen Operationsdauer und -kapazitäten bei, was sich positiv auf die Wirtschaftlichkeit auswirkt.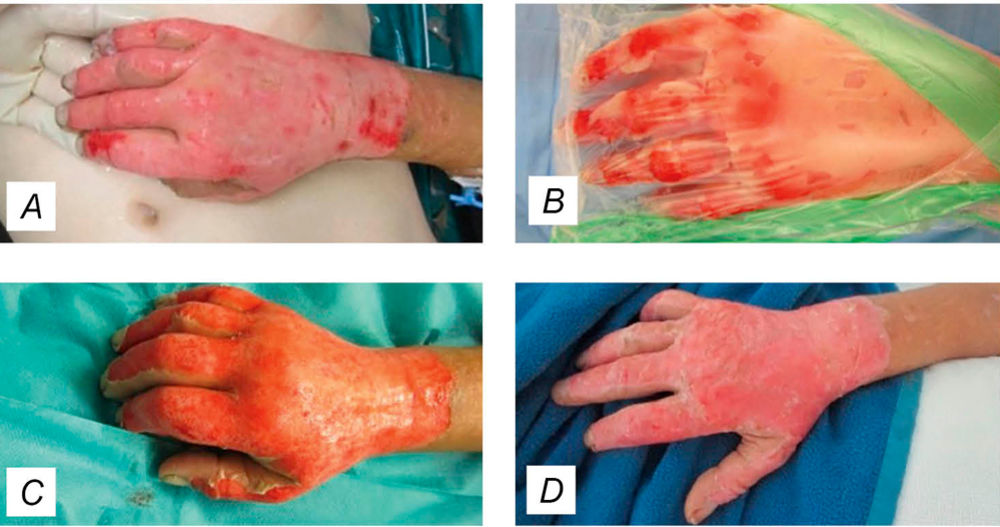
Abbildung 9: Enzymatisches Débridement. (A) 2a-b°-Verbrennung nach initialem Eintrittsbad. (B) Das Enzymgemisch wird anschließend in Form eines Gels auf das zu débridierende Areal aufgetragen und verbleibt dort für vier Stunden. Ein zusätzlicher Folienverband gewährleistet einen kontinuierlichen Kontakt des Enzym-gemisches mit dem Wundgrund. (C) Dies ermöglicht ein selektives Débridement des nekrotischen Gewebes. Anschließend kann ein Verband mit alloplastischer Membran angelegt werden (siehe Abbildung 8). (D) Nach ca. zwei Wochen zeigt sich eine vollständige Reepithelisierung.
Bei tiefen, großflächigen Verbrennungen ist im Anschluss an das Débridement oft eine Transplantation körpereigener Haut erforderlich. Großflächige Verletzungen bergen eine erhöhte Infektionsgefahr, insbesondere auch durch multiresistente Keime, die gegenüber Standardtherapien und Reserveantibiotika unempfindlich sind. Tatsächlich sterben bis zu 75 Prozent der Patienten mit großflächigen Verbrennungen an den Folgen schwerer Infektionen [3]. Trotz gängiger lokaler Maßnahmen wie aseptischen Verbandswechseln und antiseptischen Substanzen breiten sich Keime meist innerhalb weniger Tage in den Wunden aus.
Eine zusätzliche, vielversprechende Option zur Bekämpfung von Infektionen und zur Förderung der Wundheilung bietet die Kaltplasmatherapie [5, 6]. Kaltplasma liegt im Zustand eines „nicht-thermischen“ Plasmas vor, bei dem nur die Elektronen hohe Energien haben, während die schweren Teilchen, wie Ionen und Moleküle, fast Raumtemperatur beibehalten. Diese Eigenschaft ermöglicht es, dass das Plasma aktiv gegen Mikroorganismen und zur Förderung der Wundheilung eingesetzt werden kann, ohne zytotoxisch auf umliegendes vitales Gewebe zu wirken. Kaltplasma zeigt eine wirkungsvolle antimikrobielle Wirkung: Die energiereichen Teilchen, insbesondere reaktive Sauerstoff- (ROS) und Stickstoffspezies (RNS), greifen die Zellwände von Bakterien an, verursachen Schäden an der DNA und führen zur Lyse der Bakterienzellen [7]. Darüber hinaus moduliert Kaltplasma die Entzündungsreaktion, indem es die Produktion entzündungsfördernder Zytokine wie IL-1 und TNF-α verringert und gleichzeitig entzündungshemmende Zytokine wie IL-10 fördert [8, 9]. Kaltplasma stimuliert zudem die Wundheilung, indem es die Migration und Proliferation von entscheidenden Zellen wie Fibroblasten und Keratinozyten fördert [10]. Zusätzlich unterstützt Kaltplasma die Neoangiogenese, was die Durchblutung im Wundbereich verbessert und die Versorgung mit Sauerstoff und Nährstoffen optimiert. Desweiteren trägt Kaltplasma dazu bei, den pH-Wert zu regulieren und einen optimalen pH-Bereich in der Wunde wiederherzustellen, was die Zellvitalität und die Aktivität von Wundheilungsenzymen unterstützt [8].
Fazit
Alloplastische Polylactid-Membranen bieten einen effektiven temporären Hautersatz bei oberflächlichen bis tieferen Verbrennungen und unterstützen die Heilung durch pH-Regulierung. Für die Entfernung des nekrotischen Gewebes bei tiefergehenden Verbrennungen kann das schonendere enzymatische Débridement in Erwägung gezogen werden. Zur Infektionskontrolle bei großflächigen Verletzungen zeigt die Kaltplasmatherapie großes Potenzial, da sie antimikrobiell wirkt, die Wundheilung stimuliert und das pH-Milieu optimiert.
Die Autoren erklären, dass sie keine finanziellen oder persönlichen Beziehungen zu Dritten haben, deren Interessen vom Manuskript positiv oder negativ betroffen sein könnten.
Das Literaturverzeichnis kann im Internet unter www.bayerisches-aerzteblatt.de (Aktuelles Heft) abgerufen werden.
Autoren

Professor Dr. med. P. Niclas Broer,

Dr. med. Dipl. Sportwiss. Elem Safi,

Privatdozentin Dr. med. Lisanne Grünherz
München Klinik Bogenhausen, Plastische Chirurgie, Englschalkinger Str. 77, 81925 München
Teilen:
Das könnte Sie auch interessieren: