Neu in der Virologie
 Virologie (tunanon – stock.adobe.com)
Virologie (tunanon – stock.adobe.com)
Nachdem in den Pandemiejahren alle Aufmerksamkeit dem SARS-CoV-2 galt, gelingt es nun den Blick auch wieder verstärkt auf andere Viruserkrankungen zu richten. Wir haben daher drei virologische Themengebiete ausgewählt, bei denen es wesentliche Neuerungen gegeben hat:
- Die mit Abstand größten Fortschritte sind bei der Prävention von Erkrankungen durch das „Respiratorisches Synzytial-Virus“ (RSV) zu verzeichnen.
- Die gezielte Depletion von B-Zellen im Rahmen der Therapie von B-Zell-Lymphomen und Autoimmunerkrankungen führt zu einer erhöhten Empfänglichkeit für schwer verlaufende Virusinfektionen und erfordert veränderte diagnostische Vorgehensweisen.
- Nachdem die HIV-Infektion durch die antiretrovirale Therapie zu einer gut behandelbaren chronischen Erkrankung mit weitgehend normaler Lebenserwartung geworden ist, haben sich in den vergangenen Monaten große Fortschritte auch in der Verhinderung der HIV-Infektion bei Personen mit hohem Infektionsrisiko ergeben.
Fall 1: Neue Möglichkeiten der RSV-Immunprophylaxe
In einer der zurückliegenden Wintersaisons wurde bei einem drei Wochen alten Frühgeborenen (32 + 4 SSW, APGAR-Werte 7/9/10, Geburtsgewicht 1.310 g), aufgrund klinischer Zeichen einer Atemwegsinfektion, eine respiratorische Multiplex-PCR aus einem Nasen-/Rachen-Abstrich durchgeführt. In dieser Untersuchung konnte RSV-RNA in hoher Konzentration (ct-Wert 20,9 in der real-time PCR) nachgewiesen werden. Im Rahmen der supportiven Therapie wurde eine Verlegung auf die pädiatrische Intensivstation mit invasiver Beatmung über neun Tage erforderlich. In der röntgenologischen Untersuchung zeigte sich das Bild einer ausgeprägten Bronchopneumonie (siehe Abbildung 1). Zwei Wochen nach erfolgreicher Extubation konnte der Säugling nach Hause entlassen werden.
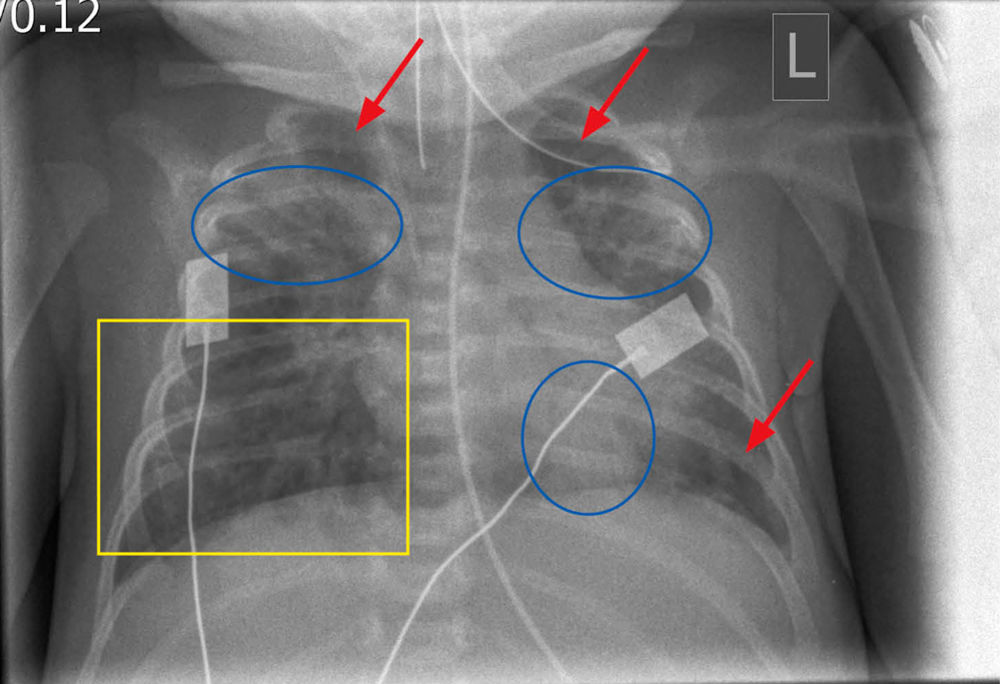
Abbildung 1: Peribronchiale Mehrzeichnung (gelbes Rechteck), disseminierte Atelektasen (blaue Ellipsen)
und Überblähung (rote Pfeile) bei RSV-Pneumonie.
Mit freundlicher Genehmigung zur Verfügung gestellt von Professor Dr. Michael Uder, unter Mitarbeit von Dr. Martin Zeilinger,
Radiologisches Institut des Uniklinikums Erlangen.
Diskussion
Die Erstinfektion mit RSV erfolgt fast immer bereits im ersten oder spätestens im zweiten Lebensjahr während der Wintersaison. Neben typischen Erkältungssymptomen kann es bei Übergreifen auf die unteren Atemwege zu (Tachy-)Dyspnoe, Bronchitis, Bronchiolitis und Pneumonien kommen. Das Risiko für schwere hospitalisierungspflichtige Verläufe ist zwar, wie im Fall dargestellt, bei Frühgeborenen und Vorerkrankten erhöht, aber ca. 80 Prozent der im Krankenhaus behandelten Fälle betreffen zuvor unauffällige Kleinkinder. Insgesamt dürfte aktuell jedes 56. Neugeborene im ersten Lebensjahr wegen einer RSV-Infektion stationär behandelt werden [1]. Präventionsmaßnahmen sollten daher nicht auf Risikokinder beschränkt bleiben, die bisher bereits durch monatliche Gabe eines neutralisierenden monoklonalen Antikörpers (Palivizumab) geschützt werden konnten.
Mit der Entwicklung eines in-vitro höherpotenten monoklonalen Antikörpers mit verlängerter Wirkdauer ist nun eine passive Immunisierung bei allen Kleinkindern möglich. Dieser neue Antikörper (Nirsevimab, Beyfortus®) gegen das Fusions (F)-Protein von RSV muss nur noch einmal zu Beginn der Wintersaison intramuskulär verabreicht werden und vermittelt dann für fünf Monate einen 80-prozentigen Schutz vor RSV-Erkrankungen.
Die STIKO empfiehlt daher seit Juni 2024 für alle zwischen Oktober und März Geborenen möglichst rasch nach Geburt eine passive Immunisierung mit Nirsevimab [1]. Die zwischen April und September Geborenen sollen den Antikörper kurz vor der RSV-Saison erhalten. Bemerkenswerterweise scheint die passive Immunisierung vor der RSV-Erkrankung zu schützen, nicht aber vor der Infektion mit dem Virus.
Darauf weisen Untersuchungen hin, die zeigen, dass Kinder, die Nirsevimab erhalten haben, fast genauso häufig infektionsinduzierte Antikörper gegen RSV entwickeln wie unbehandelte Kinder [2]. Die Entwicklung eigener Immunantworten dürfte den Vorteil haben, dass nach Abfallen der Nirsevimab-Konzentration RSV-Infektionen auch langfristig besser kontrolliert werden können und es nicht einfach nur zu einer Verschiebung der schweren RSV-Erkrankungen um eine Wintersaison kommt.
Eine Alternative zur passiven Immunisierung aller Kleinkinder mit Nirsevimab könnte die aktive Impfung von Schwangeren mit dem von der Europäischen Arzneimittel-Agentur (EMA) zugelassenen Impfstoff Abrysvo ® (bivalenter, rekombinanter Impfstoff gegen RSV) sein. Die durch die Impfung induzierten maternalen Antikörper werden pränatal von den Schwangeren auf die Kinder übertragen und vermitteln damit ebenfalls einen passiven Säuglingschutz vor RSV-Erkrankungen. Da die aktuelle Datenlage keine abschließende Bewertung eines möglichen Zusammenhangs zwischen Frühgeburtlichkeit und Impfung erlaubt, wird die RSV-Impfung Schwangerer bisher von der STIKO nicht empfohlen.
Eine zweite Häufung von schweren RSV-Erkrankungen ist bei Älteren und bei Personen mit schweren Vorerkrankungen zu beobachten. Die Häufigkeit und Schwere der Symptome der RSV-Infektionen in diesen Personengruppen ist vergleichbar zur Influenza A und nimmt mit dem Alter zu. Seit dieser Saison empfiehlt die STIKO daher allen Personen über 75 Jahren und Personen im Alter von über 60 Jahren mit schweren Grunderkrankungen eine einmalige saisonale RSV-Impfung [3]. Zu den das RSV-Risiko steigernden Grunderkrankungen gehören Immundefizienzen, COPD und Asthma bronchiale, chronische Herzinsuffizienz und koronare Herzerkrankungen, chronische Nierenerkrankungen und Diabetes mellitus, sowie chronische neurologische und neuromuskuläre Erkrankungen. Da der konkrete Zusammenhang zwischen Schweregrad der jeweiligen Grunderkrankung und Erhöhung des RSV-Risikos zurzeit nicht eindeutig bekannt ist, gilt es bei den 60- bis 74-Jährigen zu einer individuellen Entscheidungsfindung zu kommen, die auch die persönlichen Präferenzen der Patientinnen und Patienten berücksichtigt.
Die einmalige Impfung schützt bei nicht-immundefizienten Personen im Alter von über 60 Jahren für mindestens zwei Saisons mit einer Wirksamkeit von ca. 67 Prozent vor RSV-bedingten Erkrankungen der unteren Atemwege und wird gut vertragen. Aktuell sind zwei proteinbasierte Impfstoffe (Abrysvo®, Arexvy®) von der EMA zugelassen und von der STIKO empfohlen. Ein seit August dieses Jahres von der EMA zugelassener mRNA-Impfstoff (mResvia) wurde von der STIKO bisher noch nicht bewertet.
Alle drei Impfstoffe bauen auf jahrzehntelanger Grundlagenforschung zur Struktur und Funktion viraler Oberflächenproteine auf. Diese hat es ermöglicht, auch das F-Protein von RSV, die aktive Komponente der Impfstoffe, in der sogenannten Präfusionskonformation herzustellen. Das in die Membran des Viruspartikel eingelagerte F-Protein weist in der Präfusionskonformation eine große innere Spannung auf. Durch Bindung an Oberflächenstrukturen der Zielzelle wird eine plötzliche Konformationsänderung ausgelöst, die dazu führt, dass sich Teile des F-Proteins in die Membran der Zielzelle bohren und die Fusion der Virusmembran mit der Membran der Zielzelle initiieren. Durch Austausch einzelner Aminosäuren in den molekularen Gelenken innerhalb des F-Proteins konnten diese künstlich derart versteift werden, dass das F-Protein auch in löslicher Form die Präfusionskonformation beibehält und keine spontane Strukturumlagerung in die Postfusionskonformation erfolgt [4]. Damit wurde es möglich, genau mit derjenigen Konformation des F-Proteins zu impfen, die für die Induktion neutralisierender Antikörper optimal ist und gegen die auch Nirsevimab gerichtet ist. Dieses molekulare Design hat wesentlich zur Wirksamkeit der RSV-Impfstoffe beigetragen.
Auch wenn bei uns die allermeisten intensivmedizinisch behandelten RSV-Erkrankungen bei Kleinkindern nicht tödlich verlaufen, führen die RSV-Erkrankungen zu einer großen Belastung des familiären Umfelds.
Mit Ausnahme der stationären Entbindung dürfte auch in Deutschland RSV die häufigste Ursache für Krankenhausaufenthalte bei Säuglingen sein. Auf Grund der Häufigkeit der RSV-Erkrankungen ist daher die Prävention nicht nur im Sinne des Individualschutzes von Bedeutung, sondern sollte es auch ermöglichen, die Überlastung der Kinderkliniken und Praxen der niedergelassenen Pädiater während der RSV-Saison zu vermeiden. Es ist ferner zu erwarten, dass Nirsevimab und die RSV-Impfstoffe auch außerhalb der aktuellen Zulassung bei verschiedenen Formen der Immunsuppression von Nutzen sein dürften.
Fall 2: FSME-Infektion unter B-Zell-Depletion
Eine 54-jährige Patientin mit rheumatoider Arthritis wurde nach unzureichender medikamentöser Therapie mit verschiedenen Immunsuppressiva (Methotrexat, Leflunomid, Etanercept und Tocilizumab) auf eine Immunsuppression mit dem monoklonalen anti-CD20-Antikörper Rituximab umgestellt. Fünf Monate nach der vierten Rituximab-Dosis erfolgte bei Fieber, Kopfschmerzen und Hemiparese eine stationäre Aufnahme. Die Laborparameter zeigten systemische Entzündungszeichen (11.200 Leukozyten/µl, CRP 102 mg/L). Im Liquor fanden sich eine gemischte Pleozytose (272 Leukozyten/µl) sowie eine erhöhte Proteinkonzentration (2,3 g/l). Unter empirischer Antibiotikatherapie verschlechterte sich der neurologische Zustand der Patientin. Eine zunehmende Vigilanzminderung und fortschreitende Tetraparese erforderten schließlich eine Analgosedierung mit Intubation und invasiver Beatmung.
Die kranielle MRT-Untersuchung zeigte Läsionen der weißen Substanz in Thalamus (Abbildung 2), Mittelhirn und Kleinhirn mit fortschreitender Obstruktion des Aquädukts und Hydrozephalus. Bei klinischem Verdacht auf eine erregerbedingte Enzephalitis war die initiale virologische (HSV, VZV, CMV, EBV, Enterovirus, HIV) und (allgemein-)bakteriologische Infektionsdiagnostik negativ. Eine RT-PCR für FSME-RNA im Liquor war jedoch an den Tagen 4 und 6 nach Hospitalisation positiv. Eine spätere Liquorprobe von Tag 13 sowie eine Urinprobe von Tag 7 waren jeweils negativ für FSME-RNA. FSME-spezifische IgM- oder IgG-Antikörper waren zu keinem Zeitpunkt im Serum oder Liquor nachweisbar. Als Resultat der Rituximab-Behandlung waren im peripheren Blut immunphänotypisch keine B-Zellen vorhanden. Nach drei Wochen Intensivtherapie wurde die Patientin mit einer weiterhin ausgeprägten Tetraparese zur Rehabilitation verlegt.
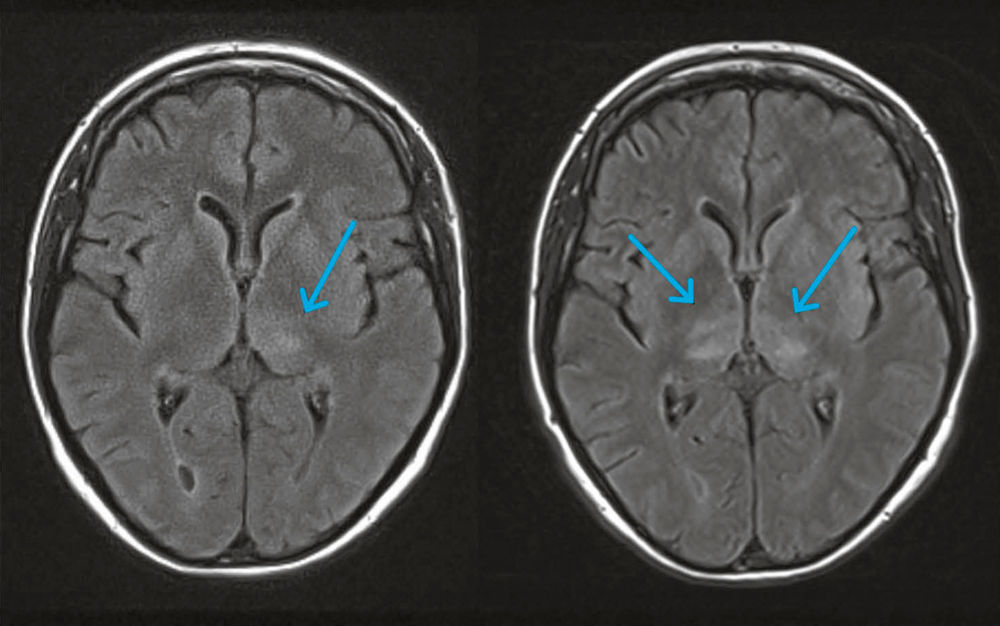
Abbildung 2: Axiales FLAIR-MRT der Rituximab-behandelten Patientin am Tag 1 (links) und Tag 3 (rechts) nach Hospitalisation.
Die FSME zeigte Läsionen ohne Kontrastmittelaufnahme im Thalamus (blaue Pfeile) sowie im Mittelhirn und Kleinhirn (nicht gezeigt).
Diskussion
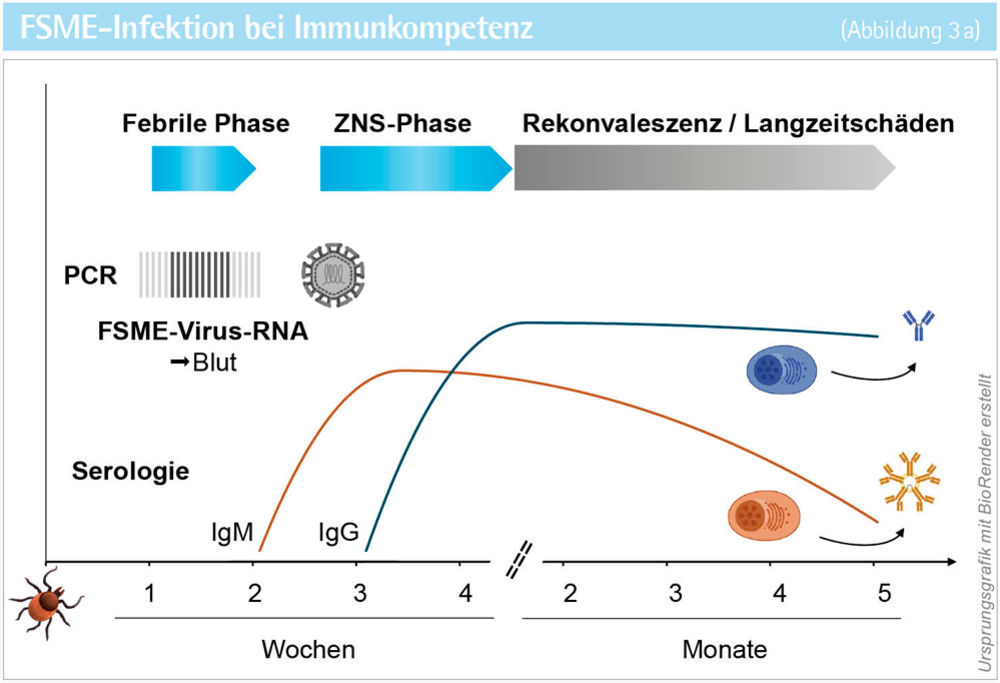
B-Zell-depletierende Therapien sind hochwirksame Mittel gegen B-Zell-Lymphome und Autoimmunerkrankungen aus dem rheumatologischen (zum Beispiel Rheumatoide Arthritis) und neuroinflammatorischen (zum Beispiel Multiple Sklerose) Formenkreis. Dazu zählen monoklonale Antikörper und Chimäre Antigenrezeptor (CAR)-T-Zellen gegen B-Zell-Marker (CD19, CD20, CD79b). Der zunehmende Einsatz dieser Art der Immunsuppression bedingt neue Herausforderungen bezüglich Infektionsrisiko, Diagnostik, Krankheitsverlauf und Impferfolg bei viralen wie nicht-viralen Infektionen. Im vorgestellten Fall einer seronegativen FSME-Infektion nach Rituximab-Therapie waren mehrere Besonderheiten im Krankheitsverlauf und der Diagnostik zu verzeichnen [5]. Die FSME zeigt üblicherweise einen biphasischen klinischen Verlauf (siehe Abbildung 3 a). Nach einer ersten fieberhaften Phase mit grippalen Symptomen folgt ein fieberfreies Intervall von einigen Tagen. Nur bei einem Teil der Infizierten treten anschließend neurologische Symptome auf. In dieser zweiten ZNS-Phase sind FSME-IgM-Antikörper zuverlässig nachweisbar, während der Direktnachweis von FSME-RNA im Liquor schon wieder negativ ist [6]. Bei immunkompetenten Patienten mit neurologischen Symptomen kann deshalb eine FSME durch das Fehlen von FSME-IgM-Antikörpern im Serum mit hoher Wahrscheinlichkeit ausgeschlossen werden (siehe Abbildung 3 a). Bei der vorgestellten Patientin waren allerdings zu keinem Zeitpunkt FSME-IgM- oder -IgG-Antikörper im Serum oder Liquor nachweisbar. Nur durch die zusätzliche, sonst nicht routinemäßig durchgeführte PCR-Untersuchung des Liquors auf FSME-RNA konnte die Diagnose einer FSME gestellt werden. Dieser Fall verdeutlicht, dass B-Zell-depletierende Therapien über Monate hinaus falsch negative Antikörpertests verursachen können, sodass für die Diagnose der direkte Erregernachweis mittels PCR nötig wird (siehe Abbildung 3 b). Darüber hinaus gibt es eine Vielzahl weiterer Ursachen für einen verzögerten oder fehlenden Antikörpernachweis bei systemischen Infektionen, die eine serologische Verlaufsuntersuchung sowie eine ergänzende PCR-Diagnostik erfordern (siehe Abbildung 4). Auffällig war zudem der sehr schwere klinische Verlauf der vorgestellten FSME-Erkrankung. Das Spektrum opportunistischer Virusinfektionen ist breit, wobei der spezifische Mechanismus der Immunsuppression eine unterschiedliche Suszeptibilität gegenüber verschiedenen Virusspezies bedingen kann. So führt die Depletion von B-Zellen durch gegen B-Zell-Oberflächenmoleküle gerichtete monoklonale Antikörper (zum Beispiel Rituximab) oder CAR-T-Zellen zu einem ausgeprägten humoralen Immundefekt mit einer stark verminderten oder vollständig absenten Antikörperantwort gegen de novo-Antigene im Rahmen einer Primärinfektion. Daher findet sich bei dieser Art von Immunsuppression insbesondere bei solchen Virusinfektionen, wie der FSME, ein besonders schwerer Verlauf, für deren effektive Immunkontrolle eine neutralisierende Antikörperantwort entscheidend ist [7, 8].
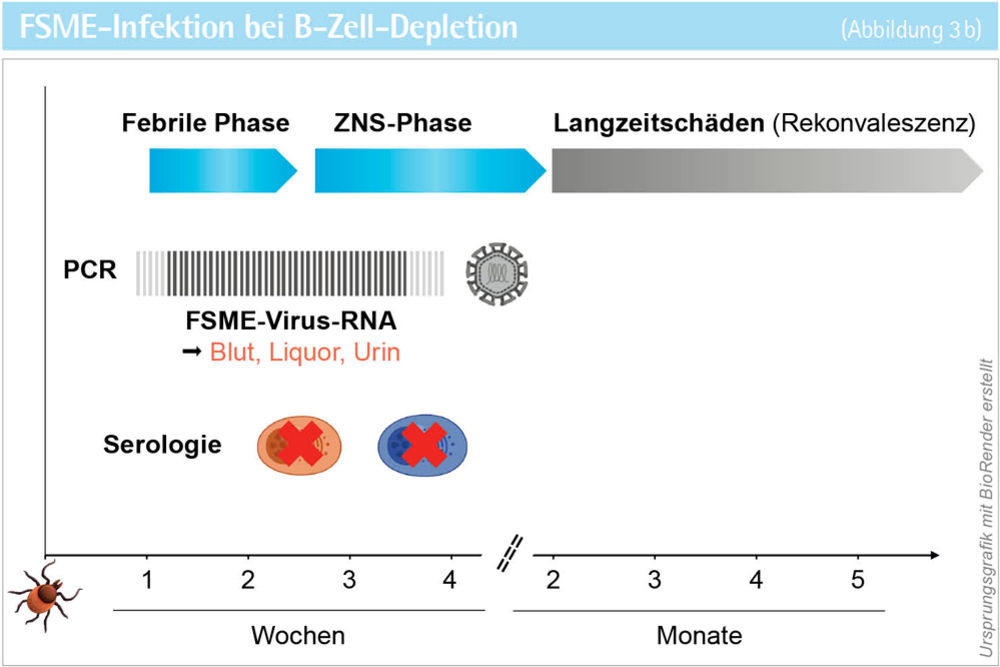
Abbildung 3 a + b: Klinischer Verlauf der FSME-Virus-Infektion und Kinetik der virusdiagnostischen Parameter bei Immunkompetenz (a)
und humoraler Immunsuppression (b ).
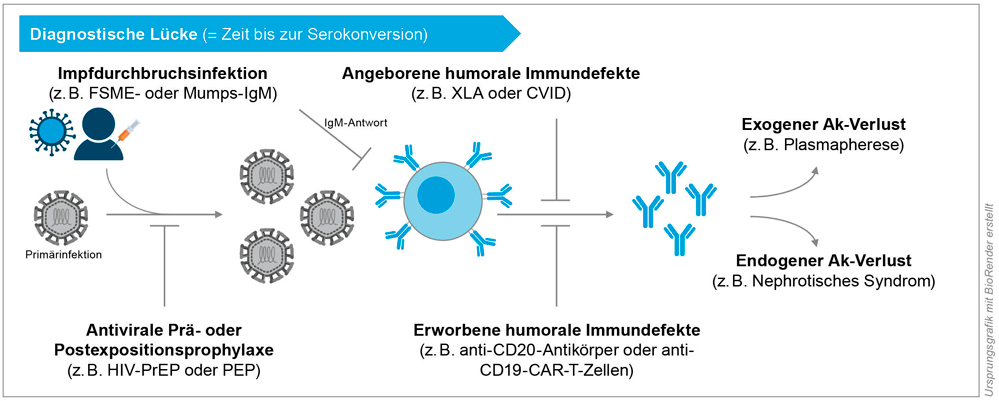
Abbildung 4: Mögliche Ursachen für einen verzögerten oder fehlenden infektionsserologischen Antikörpernachweis bei systemischen Virusinfektionen.
Abkürzungen: Ak = Antikörper; XLA = X-linked Agammaglobulinemia; CVID = Common Variable Immunodeficiency Syndrome.
Indessen wurden bei weiteren Patienten unter B-Zell-depletierender Therapie oder angeborenen humoralen Immundefekten ungewöhnlich schwere Verläufe von viralen (zum Beispiel Hantaviren, West-Nil-Virus und Enteroviren) sowie nicht-viralen (zum Beispiel Candidatus Neoehrlichia mikurensis – intrazelluläres Bakterium – und Babesia microti – Protozon) Infektionen beobachtet [9-13]. Offenbar ist bei diesen Infektionen eine neutralisierende Antikörperantwort zur schnellen effektiven Kontrolle der Infektion entscheidend, die bei den betroffenen Patienten aber fehlte.
Neben einer zunehmenden Anzahl iatrogen immunsupprimierter Patienten ist ebenso ein Anstieg der Fallzahlen für verschiedene impfpräventable Infektionskrankheiten zu verzeichnen. So wird bei der FSME sowohl eine Zunahme der gemeldeten Fälle als auch eine geografische Ausbreitung der endemischen Hochrisikogebiete in Deutschland beobachtet [14, 15, 16]. Dies unterstreicht die Bedeutung einer rechtzeitigen konsequenten Komplettierung des Impfstatus nach STIKO-Empfehlung noch vor Beginn einer immunsuppressiven Therapie, am besten bereits in der hausärztlichen Versorgung [17, 18]. Durch eine Grundimmunisierung werden langlebige CD20-negative Plasmazellen induziert, die daher durch Rituximab nicht eliminiert werden und somit auch unter Immunsuppression eine protektive sekundäre (Gedächtnis-)Immunantwort ermöglichen können. Aufgrund der Vielzahl weiterer, derzeit nicht impfpräventabler, Zecken-übertragener Erreger (zum Beispiel Borrelien, Rickettsien und Neoehrlichen) sowie dem Vorkommen von FSME-Impfdurchbruchsinfektionen auch bei immunkompetenten Personen ist ergänzend stets eine strikte Zecken-Expositionsprophylaxe erforderlich [19].
Der Nachweis einer FSME-Impfdurchbruchsinfektion stellt auch bei immunkompetenten Patienten eine diagnostische Herausforderung dar, da in diesen Fällen ein verzögerter FSME-IgM-Anstieg vorliegen kann. Dies erschwert die Diagnose gerade in der frühen ZNS-Phase, wenn der FSME-IgM-Nachweis (noch) negativ oder nur schwach positiv ist. In diesen Situationen wird daher eine serologische Verlaufsuntersuchung erforderlich, um einen FSME-IgM-Anstieg und einen signifikanten Anstieg des FSME-IgG-Titers erfassen zu können. Eine konventionelle serologische Diagnostik ermöglicht zudem keine Unterscheidung zwischen infektionsinduzierten und impfinduzierten FSME-Antikörpern. Am Konsiliarlabor für Frühsommer-Meningoenzephalitis (FSME) am Institut für Mikrobiologie der Bundeswehr wurde daher kürzlich ein spezieller ELISA für den Nachweis von IgG-Antikörpern gegen das Nichtstrukturprotein 1 (NS1) des FSME-Virus entwickelt, welcher zwischen einer akuten oder zurückliegenden FSME-Infektion und FSME-Impfung unterscheiden kann [20]. Antikörper gegen das replikationsassoziierte NS1-Protein werden nur im Rahmen einer Infektion gebildet, nicht jedoch infolge einer Impfung mit dem FSME-Totimpfstoff.
Ergänzend sei bemerkt, dass bei therapeutischer B-Zell-Depletion wie bei anderen Antikörpermangelzuständen die Gabe von intravenösen Immunglobulinen (IVIG) zur Antikörpersubstitution notwendig werden kann, welche wiederum weitere diagnostische Fallstricke bedingen kann. Der Nachweis von über IVIG-Präparate passiv transferierten Antikörpern kann im Rahmen einer Infektionsdiagnostik zu falsch positiven serologischen Befunden führen. So kann der Nachweis transfundierter anti-HBc-Antikörper zur irrtümlichen Diagnose einer vorausgegangenen Hepatitis B-Virus-Infektion führen. Die betroffenen, tatsächlich HBV-negativen, Patienten erhalten daraufhin eine (nicht indizierte) medikamentöse HBV-Reaktivierungsprophylaxe.
Fall 3: Späte Diagnose einer HIV-1-Infektion
Ein 45-jähriger Patient stellte sich beim Hausarzt mit starken Rückenschmerzen und Kurzatmigkeit vor. Die Laboruntersuchungen zeigten eine starke Erhöhung der Entzündungsparameter und eine Panzytopenie, daraufhin erfolgte die stationäre Aufnahme. Aufgrund des Vorliegens perianaler Kondylome wurde eine HIV-Testung durchgeführt, diese führte zur Diagnose einer HIV-1-Infektion mit einem extrem fortgeschrittenen Immundefekt
(< 10 CD4+ T Zellen/µl; Normwert ca. 500 - 1.400/µl) und einer hohen Viruslast (220.000 Kopien HIV-1-RNA/ml). In der broncho-alveolären Lavage sowie in mehreren Blutkulturen und einer Liquorprobe wurde Cryptococcus neoformans nachgewiesen. Es handelt sich also mit der Kryptokokkose als opportunistische Infektion um eine erst im Stadium AIDS diagnostizierte HIV-Infektion. Eine sofortige antiretrovirale Therapie mit Bictegravir, Emtricitabin und Tenofovir (Kombinationspräparat) bewirkte einen mehr als 100-fachen Abfall der Viruslast innerhalb einer Woche auf ca. 1.000 HIV-1-RNA Kopien/ml. Die Therapie der Kryptokokkose erfolgte zunächst mit Amphotericin B und Fluconazol, später mit Voriconazol und Flucytosin und zuletzt als Monotherapie mit Fluconazol. Die HIV-1-Viruslast war in allen ambulanten Folgeuntersuchungen unterhalb der Nachweisgrenze. Die CD4-Zellzahl stieg jedoch nur langsam und lag auch nach einem Jahr noch unter 150/µl. Der Patient erhält daher weiterhin eine Cotrimoxazol-Prophylaxe wegen des erhöhten Risikos für eine Pneumocystis-Pneumonie.
Diskussion
Trotz jahrzehntelanger Aufklärungs- und Präventionskampagnen und großer Fortschritte in der Behandlung der HIV-Infektion werden in Deutschland jedes Jahr noch etwa 3.000 HIV-Infektionen neu diagnostiziert [21]. Ein erheblicher Teil davon wird erst beim Vorliegen einer AIDS-definierenden Erkrankung diagnostiziert, also vermutlich viele Jahre nach der HIV-Infektion [22, 23]. Bei den meisten Patienten mit späterer HIV-Diagnose wird mit den verfügbaren Kombinationstherapien eine rasche Senkung der Viruslast unter die Nachweisgrenze erreicht [24], trotzdem ist die Prognose deutlich schlechter als bei einem frühen Beginn der antiretroviralen Therapie (ART). Die Mortalität von Patienten mit später HIV-Diagnose ist mit 38 Todesfällen/1.000 Patientenjahre besonders im ersten Jahr ungefähr 10-fach höher als bei einer frühen Diagnose der HIV Infektion ohne opportunistische Infektionen und CD4+ T-Zellen über > 350/µl) [25]. Bei einer lange bestehenden unerkannten HIV-Infektion besteht außerdem ein signifikantes Risiko der HIV-Transmission auf Sexualpartner. Durch eine effektive HIV-Therapie wird dieses Infektionsrisiko für Sexualpartner weitgehend eliminiert. Deshalb ist es sehr wichtig, HIV-Infektionen möglichst früh zu diagnostizieren.
Retrospektiv sind in der Anamnese von Patienten mit später HIV-Diagnose häufig verpasste Gelegenheiten zu einer früheren Diagnose zu finden. Bei Vorliegen von verschiedenen Erkrankungen geht man von einer erhöhten HIV-Prävalenz im Vergleich zur allgemeinen Bevölkerung (0,1 Prozent) aus, sodass eine HIV-Testung ausdrücklich zu empfehlen ist (Tabelle 1, modifiziert nach [26]). Ein HIV-Test sollte außerdem allen Schwangeren empfohlen werden, weil eine unerkannte HIV-Infektion auf das Kind übertragen werden kann. Diese vertikale HIV-Transmission lässt sich bei rechtzeitiger Diagnose und raschem Therapiebeginn nahezu zu 100 Prozent verhindern.
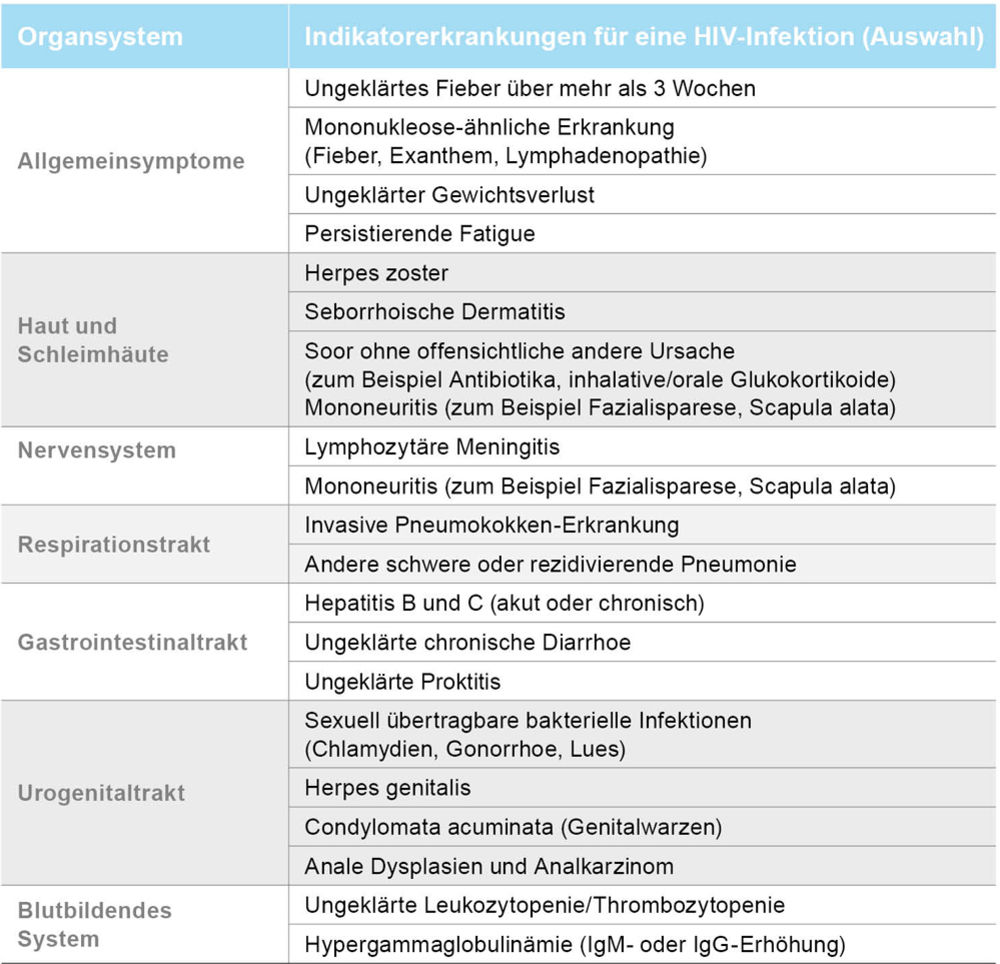
Tabelle 1: Auswahl von Symptomen unde (nicht AIDS-definierenden) Erkrankungen, bei denen eine erhöhte HIV-Prävalenz zu erwarten ist und daher eine HIV-Testung durchgeführt bzw. empfohlen werden sollte.
Dass die für die Behandlung der HIV-Infektion eingesetzten Medikamente sich nicht nur zur Verhinderung der Mutter-Kind-Transmission eignen, sondern auch die sexuelle Übertragung von HIV verhindern können, wurde schon vor 15 Jahren in unterschiedlichen Studien gezeigt. Durch einen frühen Beginn der antiretroviralen Therapie bei serodiskordanten Paaren kann das Risiko einer Übertragung auf den seronegativen Partner um über 90 Prozent reduziert werden [27], unabhängig vom Geschlecht des seropositiven Partners. Auch durch eine Präexpositionsprophylaxe (Gabe von antiretroviralen Medikamenten an nicht infizierte Personen mit hohem Infektionsrisiko), wird die Ansteckungshäufigkeit deutlich verringert. Für diese Präexpositionsprophylaxe wird vor allem die Medikamentenkombination Tenofovir/Emtricitabin eingesetzt. Damit konnte in verschiedenen Studien die Zahl der HIV-Infektionen um bis zu 90 Prozent reduziert werden [28]. Allerdings zeigten nur die Studien bei Männern, die Sex mit Männern haben, solche starken Effekte. In den Studien zur sexuellen Transmission bei Frauen waren die Effekte gering oder gar nicht vorhanden. Zwei neue Studien untersuchten als neues, langwirksames Medikament für die Präexpositionsprophylaxe den HIV-Kapsidinhibitor Lenacapavir, der nur alle sechs Monate als Injektion verabreicht werden muss. In der PURPOSE-1-Studie mit jungen Frauen aus Südafrika und Uganda fand sich in der Gruppe, die zwei Lenacapavir-Injektionen pro Jahr erhielt, keine einzige HIV-Neuinfektion, während in der gleich großen Vergleichsgruppe mit täglicher oraler Prophylaxe 39 Neuinfektionen im einjährigen Beobachtungszeitraum auftraten [29]. In der zweiten Studie, die Männer und Transgender-Personen einschloss, kam es in der vergleichbar großen Lenacapavir-Gruppe zu zwei Neuinfektionen (ein Fall pro 1.000/Beobachtungsjahre). Dies entspricht einem Rückgang der Inzidenz um 89 Prozent gegenüber der Vergleichsgruppe mit täglicher oraler Prophylaxe und um 96 Prozent im Vergleich zur Hintergrundinzidenz ohne Prophylaxe [30]. Mit zwei Injektionen Lenacapavir pro Jahr wurden HIV-Neuinfektionen bei Personen mit hohem Infektionsrisiko (die Neuinfektionsrate ohne Therapie lag in beiden Studien bei etwa 2,4 Prozent pro Jahr) nahezu vollständig verhindert. Dies eröffnet neue Perspektiven für die Bestrebungen, HIV durch eine Kombination aus früher Diagnosestellung, effektiver Behandlung der Infizierten und der Verhinderung von Neuinfektionen in Hochrisikogruppen langfristig zu eliminieren. Noch zu klären sind Fragen zur Finanzierbarkeit, langfristigen Verträglichkeit und zu möglichen negativen Folgen durch die Vernachlässigung anderer Präventionsmaßnahmen.
Kasten Das Wichtigste einfügen
Die Autoren erklären, dass sie keine finanziellen oder persönlichen Beziehungen zu Dritten haben, deren Interessen vom Manuskript positiv oder negativ betroffen sein könnten.
Das Literaturverzeichnis kann im Internet unter www.bayerisches-aerzteblatt.de (Aktuelles Heft) abgerufen werden.
Autoren und Autorin

Privatdozentin Dr. Antje Knöll
Virologisches Institut
Klinische und Molekulare Virologie
Uniklinikum Erlangen
91054 Erlangen
Teilen:
Das könnte Sie auch interessieren: